Sarcopenia Before Concurrent Chemoradiotherapy May Develop Severe Adverse Reactions in Patients with Esophageal Squamous Cell Carcinoma
-
摘要:目的
探讨进展期食管鳞状细胞癌(ESCC)同步放化疗前骨骼肌减少(肌少症)与发生3级及以上急性不良反应(AAR)和生存期的相关性。
方法回顾性分析2018年8月-2022年7月间经病理证实并接受同步放化疗(FP方案)的进展期ESCC患者的病历资料, 放化疗前在CT图像上测量骨骼肌量及身体组成成分, 分为肌少症组和非肌少症组。根据CTCAE5.0版及美国RTOG急性放射损伤标准诊断≥3级AAR。分析发生≥3级AAR的危险因素, Kaplan-Meier法计算生存率。
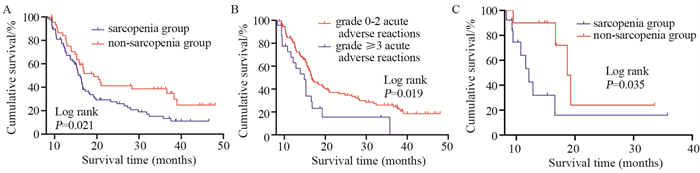
结果132例ESCC患者中肌少症组87例、非肌少症组45例, 23例(17.4%)发生3级及以上AAR。肌少症(OR: 6.034, 95%CI: 1.206~30.190, P=0.029)、骨骼肌密度降低(OR: 0.693, 95%CI: 0.492~0.976, P=0.036)、SMI (骨骼肌指数)降低(OR: 0.841, 95%CI: 0.721~0.982, P=0.028)、脂肪量增加(OR: 2.433, 95%CI: 1.194~4.958, P=0.014)与发生3级及以上AAR的风险相关。与非肌少症组(19.27(95%CI: 14.45~24.09)月)相比, 肌少症组总生存期(16.01(14.89~17.13)月)降低(χ2=5.326, P=0.021);与发生0~2级AAR患者(16.67月)相比, 3级及以上AAR患者总生存期(14.86月)减少(χ2=5.470, P=0.019)。3级及以上AAR患者中, 肌少症组总生存期(12.13月)低于非肌少症组(18.69(12.85~21.88)月, χ2=4.466, P=0.035)。
结论肌少症、骨骼肌密度减低及脂肪量增加是发生3级及以上AAR的重要预测因子, 进展期ESCC合并肌少症患者发生3级及以上AAR有生存期减少的风险。
Abstract:ObjectiveTo investigate whether sarcopenia before concurrent chemoradiotherapy is prone to grade≥3 acute adverse reactions (AAR) and shorten survival in patients with advanced esophageal squamous cell carcinoma (ESCC).
MethodsData of advanced patients with pathologically diagnosed ESCC and CCRT (FP regimen) from August 2018 to July 2022 were reviewed retrospectively.Skeletal muscle mass and body composition were measured using pre-treatment CT images, and patients were divided into sarcopenia and non-sarcopenia groups.Grade≥3 AAR was diagnosed based on CTCAE5.0 and acute radiation injury criteria of the US RTOG.Risk factors for developing grade≥3 AAR were analyzed, and survival rates were calculated by Kaplan-Meier method.
ResultsAmong 132 patients with ESCC (87 in the sarcopenia group and 45 in the non-sarcopenia group), 23(17.4%) experienced grade≥3 AAR.In multivariate regression analysis, independent risk factors for grade ≥3 AAR included the following: sarcopenia (OR: 6.034, 95%CI: 1.206-30.190, P=0.029), decreased SMD (OR: 0.693, 95%CI: 0.492-0.976, P=0.036), decreased SMI (OR: 0.841, 95%CI: 0.721-0.982, P=0.028), and increased FMI (OR: 2.433, 95%CI: 1.194-4.958;P=0.014).The OS rates were 16.01 months (95%CI: 14.89-17.13) in the sarcopenia group and 19.27 months (95%CI: 14.45-24.09) in the non-sarcopenia group (χ2=5.326, P=0.021) as well as 14.86 months (95%CI: 11.30-18.42) for patients with grade≥3 AAR and 16.67 months (95%CI: 14.91-18.43) for patients with grade 0-2 AAR (χ2=5.47, P=0.019).Among patients with grade≥3 AAR, the OS rates were 12.13 months (95%CI: 10.15-14.11) in the sarcopenia group and 18.69 months (95%CI: 12.85-21.88) in the non-sarcopenia group (χ2=4.466, P=0.035).
ConclusionSarcopenia, decreased skeletal muscle density, and increased fat mass are important predictors of grade≥3 AAR.The OS of patients with sarcopenia and grade≥3 AAR may be reduced.
-
0 引言
宫颈小细胞神经内分泌癌(small cell neuroendocrine carcinoma, SCNEC)是一种较为罕见的原发于宫颈的神经内分泌性肿瘤,约占宫颈恶性肿瘤的1%~2%[1-2]。在各种类型的宫颈癌中,SCNEC是一种侵袭性强的病理类型[3-8]。但因为该类病例较少,目前尚无规范化的治疗。本研究对101例宫颈小细胞神经内分泌癌患者的临床病理资料及生存状况进行分析,旨在探讨SCNEC合理的治疗方案及预后相关因素,为此类患者治疗及预后判断提供临床依据。
1 资料与方法
1.1 临床资料
收集2007年1月—2018年6月在江西省妇幼保健院确诊并完成治疗的101例宫颈小细胞神经内分泌癌患者作为研究对象。患者确诊年龄25~73岁,中位年龄44岁,其中41~50岁者有40例。宫颈局部肿瘤直径 > 4 cm患者34例,≤4 cm患者67例。患者临床资料及年龄分布见表 1。所有患者均知情同意。
表 1 101例SCNEC患者临床病理特征Table 1 Clinical and pathological features of 101 SCNEC patients
1.2 方法
1.2.1 研究对象纳入标准
(1)所有患者接受治疗前均经江西省妇幼保健院病理确诊为宫颈小细胞神经内分泌癌;(2)临床分期盆腔检查均经三位以上有经验的妇科肿瘤专业医师检查确定;(3)治疗前均未接受任何干预性治疗,且初始治疗及后续治疗均在同一机构完成;(4)纳入研究的患者治疗模式均为手术+术后补充放化疗(下文简称手术治疗组)或根治性放化疗,且按计划完成全部治疗;(5)全部患者术后病理检查均在同一医院完成;(6)建立了完整的病历档案,并持续随访,具备完整的住院及门诊复查病历资料。
1.2.2 手术方式
72例手术治疗患者手术方式为广泛子宫切除+盆腔淋巴结切除术±腹主动脉旁淋巴结切除术,其中47例行腹主动脉旁淋巴结切除术。69例行双附件切除,其余3例保留一侧卵巢且进行了保留卵巢的组织活检。
1.2.3 放疗
放疗包括体外照射+腔内后装治疗,体外照射采用全盆腔体外照射+中央遮盖体外照射。体外照射剂量:全盆照射肿瘤剂量30~40 Gy,中央遮盖照射剂量15~25 Gy,放疗频率及强度:每周5次,每次分割剂量2 Gy。腔内后装采用高剂量率后装治疗设备,放射源为铱192。放疗剂量参照点A点累积剂量要求60~70 Gy;B点累积剂量要求54~56 Gy。放疗期间均给予铂类为基础的同步化疗。
1.2.4 随访
通过电话或门诊复查方式进行随访,截止时间为2018年9月。
1.3 统计学方法
采用GraphPad7.0统计软件对不同组间患者生存率进行显著性比较。生存分析采用Kaplan-Meier法,生存率的比较采用Log rank检验。P < 0.05为差异有统计学意义。
2 结果
72例手术组患者中,2例失访,19例死亡,51例生存。19例死亡患者生存时间1~63月,中位生存时间19月,平均生存时间18.5月。51例生存的患者中,生存时间1~139月,中位生存时间39月,平均生存时间47.3月。随访5年以上共33例,生存20例,五年生存率60.6%。
29例根治性放化疗患者中,随访5年以上20例,其中2例失访,死亡15例,生存3例,五年生存率15%。生存时间1~75月,中位生存时间21月。3例生存患者年龄分别为40岁、41岁、46岁,临床分期均为ⅡB期,病理均为单纯的宫颈小细胞神经内分泌癌,化疗方案均为多西他赛+卡铂,放疗给予根治性同步放化疗。ⅠB1期~ⅡA期手术治疗组患者生存率优于ⅡB期~Ⅳ期期根治性放化疗组患者(P=0.0025),见图 1。
72例接受手术治疗的患者均行宫颈癌根治术+盆腔淋巴结切除术,47例行腹主动脉旁淋巴结切除术,其中1例(1/47, 2.12%)腹主动脉旁淋巴结阳性。27例(27/72, 37.5%)盆腔淋巴结阳性。淋巴结阳性与阴性患者生存曲线比较差异有统计学意义,淋巴结阴性患者生存优于淋巴结阳性患者(P=0.0004),见图 2。
72例手术治疗的患者中,按病理类型分,单纯SCNEC例41例,混合其他病理类型者31例,其中混合有腺癌19例,鳞癌9例,腺鳞癌3例。混合型与单纯型SCNEC生存曲线比较差异无统计学意义(P=0.0546),见图 3。
3 讨论
WHO分类将宫颈神经内分泌肿瘤分为低级别神经内分泌肿瘤(包括类癌及非典型类癌)和高级别神经内分泌肿瘤(包括小细胞神经内分泌癌和大细胞神经内分泌癌)。目前无公认的、规范有效的治疗方案,对于宫颈神经内分泌肿瘤多参照常见宫颈癌的分期治疗原则,主张手术、化疗和放疗的综合性治疗,但其治疗是否应有别于宫颈鳞癌需要更大样本、多中心的研究。美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南也将SCNEC列入特殊类型宫颈癌。
关于SCNEC患者生存率及预后方面的研究,Ishikawa等的一项多中心研究显示淋巴血管间隙受侵是患者的总生存率及无进展生存率的重要预后因素,盆腔淋巴结转移是DFS的重要预后影响因素[9]。Cohen等研究发现Ⅰ~ⅡA、ⅡB~ⅣA、ⅣB期5年生存率分别为36.8%、9.8%和0[10],本研究结果显示临床分期与预后密切相关,各期别5年生存率均较以往文献报道略高。FIGO分期是较为公认的影响患者预后的最重要的独立危险因素[11-12]。由于SCNEC侵袭性强,易发生远处转移,有学者认为早期SCNEC患者手术联合化疗的预后优于单纯手术者[13-14]。本研究中ⅠB~ⅡA期患者均采用手术+放化疗综合治疗,5年总生存率60%以上,提示手术联合术后放化疗对此类患者疗效较好。
宫颈小细胞神经内分泌癌早期容易发生转移,但从72例早期患者手术情况发现,仅1例(1.39%)发生卵巢转移。提示对于存在生育要求的年轻SCNEC患者,是否一定要行卵巢切除有待进一步研究证实。研究证实,SCNEC好发转移器官为肺、脑、肝,预后差[15-16]。
此外,几乎所有文献均支持此类肿瘤早期即容易发生远处转移,本研究资料中,死亡病例主要病因为肺转移、全身转移,临床观察也支持上述观点。关于淋巴结转移,有研究认为,即使是早期的SCNEC患者,淋巴结转移也非常普遍,淋巴结转移率为41.6%~57%[17]。本研究中,72例早期SCNEC患者手术后病理提示淋巴结转移22例,转移率37.5%,与文献报道接近,但是对于腹主动脉旁淋巴结,72例患者中47例患者行腹主动脉旁淋巴结活检或切除,仅1例发生腹主动脉旁淋巴结转移,转移率仅为2.13%,远低于盆腔淋巴结转移率。这一研究结果提示我们,即便是早期SCNEC患者,化疗对于控制转移也有重要的临床意义。
与以往报道相比,本研究中手术患者术后均补充了放化疗,且均达到6个疗程,其中49例采用紫杉醇+铂类化疗方案,23例采用顺铂+环磷酰胺+表阿霉素化疗方案,提示手术后放化疗的必要性。
总之,宫颈小细胞神经内分泌癌发病率低、恶性程度高、易发生远处转移和复发,患者预后差、死亡率高、有独特的病理特征,诊断主要依据病理诊断和免疫组织化学结果可提高其诊断的准确率。由于研究样本少,尚需大量的临床资料及多中心研究探索最佳早期诊断及治疗的方法。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:陈晓霞:研究设计、论文撰写及修改王飞:研究设计指导,论文审阅刘彩云、李晓峰、拾博、王强:临床资料的收集、测量、分析和汇总 -
表 1 进展期食管鳞癌患者的基本情况
Table 1 Demographics of patients with advanced ESCC

表 2 进展期食管鳞状细胞癌同步放化疗急性不良反应情况
Table 2 Acute adverse reactions in patients with advanced ESCC who received concurrent chemoradiotherapy

表 3 进展期食管鳞癌同步放化疗≥3级急性不良反应影响单、多因素分析
Table 3 Univariate and multivariate analyses of influencing factors of grade ≥3 AAR in patients with advanced ESCC who received concurrent chemoradiotherapy

-
[1] Fokas E, Schlenska-Lange A, Polat B, et al. Chemoradiotherapy Plus Induction or Consolidation Chemotherapy as Total Neoadjuvant Therapy for Patients With Locally Advanced Rectal Cancer: Long-term Results of the CAO/ARO/AIO-12 Randomized Clinical Trial[J]. JAMA Oncol, 2022, 8(1): e215445. doi: 10.1001/jamaoncol.2021.5445
[2] 刘彩云, 杨志刚, 孙晓忠, 等. CT影像参数评价进展期食管癌放化疗疗效及其与骨骼肌消耗程度关联性[J]. 中华肿瘤防治杂志, 2021, 28(24): 1894-1901. https://www.cnki.com.cn/Article/CJFDTOTAL-QLZL202124009.htm Liu CY, Yang ZG, Sun XZ, et al. CT image evaluation of the efficacy of chemoradiotheray and skeletal muscle consumption advanced esophageal cancer[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2021, 28(24): 1894-1901. https://www.cnki.com.cn/Article/CJFDTOTAL-QLZL202124009.htm
[3] Huang X, Lv LN, Zhao Y, et al. Is skeletal muscle loss associated with chemoradiotherapy toxicity in nasopharyngeal carcinoma patients? A prospectivestudy[J]. Clin Nutr, 2021, 40(1): 295-302. doi: 10.1016/j.clnu.2020.05.020
[4] Nilsson MP, Johnsson A, Scherman J. Sarcopenia and dosimetric parameters in relation to treatment-related leukopenia and survival in anal cancer[J]. Radiat Oncol, 2021, 16(1): 152. doi: 10.1186/s13014-021-01876-5
[5] Chargi N, Bashiri F, Wendrich AW, et al. Image-based analysis of skeletal muscle mass predicts cisplatin dose-limiting toxicity in patients with locally advanced head and neck cancer[J]. Eur Arch Otorhinolaryngol, 2022, 279(7): 3685-3694. doi: 10.1007/s00405-021-07229-y
[6] Dijksterhuis WPM, Pruijt MJ, van der Woude SO, et al. Association between body composition, survival, and toxicity in advanced esophagogastric cancer patients receiving palliative chemotherapy[J]. J Cachexia Sarcopenia Muscle, 2019, 10(1): 199-206. doi: 10.1002/jcsm.12371
[7] Ota T, Ishikawa T, Endo Y, et al. Skeletal muscle mass as a predictor of the response to neo-adjuvant chemotherapy in locally advanced esophageal cancer[J]. Med Oncol, 2019, 36(2): 15. doi: 10.1007/s12032-018-1242-0
[8] 孙晓忠, 刘彩云, 杨志刚, 等. 术前肌肉减少症胸段食管癌患者的术后疗效分析[J]. 中华肿瘤防治杂志, 2021, 28(13): 1007-1013. https://www.cnki.com.cn/Article/CJFDTOTAL-QLZL202113007.htm Sun XZ, Liu CY, Yang ZG, et al. Analysis of the curative effect of sarcopenia diagnosed before operation in patients with thoracic esophageal cancer[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2021, 28(13): 1007-1013. https://www.cnki.com.cn/Article/CJFDTOTAL-QLZL202113007.htm
[9] Freites-Martinez A, Santana N, Arias-Santiago S, et al. Using the Common Terminology Criteria for Adverse Events (CTCAE-Version 5.0) to Evaluate the Severity of Adverse Events of Anticancer Therapies[J]. Actas Dermosifiliogr (Engl Ed), 2021, 112(1): 90-92. doi: 10.1016/j.ad.2019.05.009
[10] Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC)[J]. Int J Radiat Oncol Biol Phys, 1995, 31(5): 1341-1346. doi: 10.1016/0360-3016(95)00060-C
[11] Panje CM, Höng L, Hayoz S, et al. Skeletal muscle mass correlates with increased toxicity during neoadjuvant radiochemotherapy in locally advanced esophageal cancer: A SAKK 75/08 substudy[J]. Radiat Oncol, 2019, 14(1): 166. doi: 10.1186/s13014-019-1372-3
[12] Lee J, Lin JB, Wu MH, et al. Muscle radiodensity loss during cancer therapy is predictive for poor survival in advanced endometrial cancer[J]. J Cachexia Sarcopenia Muscle, 2019, 10(4): 814-826. doi: 10.1002/jcsm.12440
[13] Colomba E, Alves Costa Silva C, Le Teuff G, et al. Weight and skeletal muscle loss with cabozantinib in metastatic renal cell carcinoma[J]. J Cachexia Sarcopenia Muscle, 2022, 13(5): 2405-2416. doi: 10.1002/jcsm.13021
[14] Ganju RG, Morse R, Hoover A, et al. The impact of sarcopenia on tolerance of radiation and outcome in patients with head and neck cancer receiving chemoradiation[J]. Radiother Oncol, 2019, 137: 117-124. doi: 10.1016/j.radonc.2019.04.023



 下载:
下载: