Clinical Characteristics of Chronic Myeloid Leukemia Patients with Deletion and Non-deletion of ASS Gene on Derivative Chromosome 9
-
摘要:目的
探讨慢性髓性白血病(CML)慢性期衍生9号染色体ASS基因缺失与非缺失患者的临床特征及疗效。
方法分析初始治疗方案为伊马替尼并采用BCR/ABL1/ASS1 3色融合探针检测ASS基因是否缺失的CML患者的临床资料,分为缺失组(n=27)和非缺失组(n=92),分析其临床特征、治疗效果及预后。
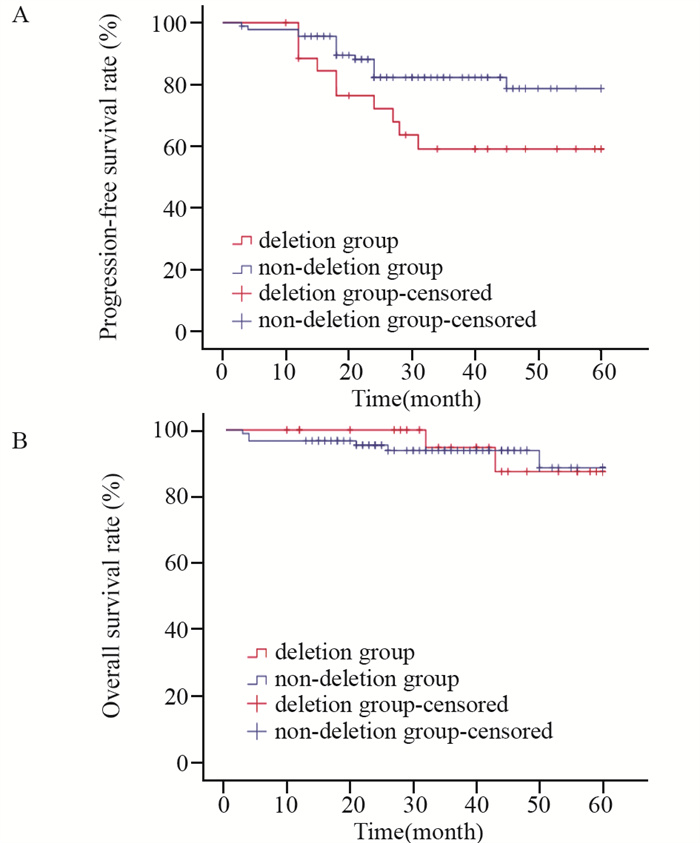
结果119例患者平均年龄37.22±12.72岁,缺失组和非缺失组患者的sokal评分差异有统计学意义(χ2=4.304, P=0.038),其他一般特征差异无统计学意义(P > 0.05)。缺失组的3个月完全细胞遗传学反应(CCyR)率及6个月CCyR率、BCR-ABLIS≤ 1%率均低于非缺失组(均P < 0.05)。随访中位数为35.0(3.0~60.0)个月,缺失组PFS低于非缺失组(χ2=4.293, P=0.038),两组OS比较差异无统计学意义(χ2=0.008, P=0.931)。
结论伊马替尼治疗的CML慢性期患者中ASS基因缺失导致治疗疗效不佳及预后不良,且更易出现疾病进展。
Abstract:ObjectiveTo investigate the clinical characteristics of patients with chronic myeloid leukemia (CML) in chronic phase with deletion and non-deletion of the argininosuccinate synthesis gene (ASS gene) on the derivative chromosome 9.
MethodsThe clinical data of patients with CML initially treated with imatinib and BCR/ABL1/ASS1 3-color fusion probe to detect ASS gene deletion were analyzed. The patients were divided into deletion group (n=27) and non-deletion group (n=92). Clinical characteristics, treatment effects, and prognosis were analyzed.
ResultsThe average age of 119 patients was 37.22±12.72 years old. The sokal score differed between the deletion and non-deletion groups (χ2=4.304, P=0.038). No statistically significant difference in other general characteristics was found (P > 0.05). The 3-month CCyR rate, 6-month CCyR rate, and BCR-ABLIS≤ 1% rate in the deletion group were lower than those in the non-deletion group (P < 0.05). The median follow-up of 119 patients was 35.0 (3.0-60.0) months. The PFS in the deletion group was lower than that in the non-deletion group (χ2=4.293, P=0.038). Overall survival was not significantly different between the two groups (χ2=0.008, P=0.931).
ConclusionThe deletion of the ASS gene in patients with chronic CML is related to the poor efficacy of imatinib treatment, poor prognosis, and high risk of disease progression.
-
0 引言
目前经胸腔镜肺叶切除、淋巴结清扫已成为早中期肺癌的标准手术方式,其手术的安全性及有效性也越来越被认可。中国人民解放军海军总医院自2009年8月至2015年8月对116例非小细胞肺癌患者采用电视胸腔镜肺叶切除(video-assisted thoracoscopic lobectomy)及系统淋巴结清扫术(systematic lymph node dissection, SLND),获得了满意的疗效。现对本组手术资料及随访数据进行总结分析,探讨胸腔镜下肺叶切除术的安全性、可靠性以及患者的并发症和生存率。
1 资料与方法
1.1 病例资料
本组共116例,男62例、女54例;中位年龄:(59.5±11.9)(范围35~82)岁,其中35~69岁81例(69.8%)、70~82岁高龄患者35例(30.2%)。患者病变位于左上肺33例、左下肺21例、右上肺30例、右中肺叶8例、右下肺24例。术前经穿刺确诊59例(鳞癌21例、腺癌38例),PET-CT诊断22例并术中冰冻确诊(鳞癌7例、腺癌15例),其余35例为术中冰冻确诊(鳞癌10例、腺癌22例、3例术后确诊腺鳞癌2例及大细胞癌1例)。本组患者不包括同期中转开胸患者。
1.2 手术方式
双腔气管内插管静脉复合全身麻醉,健侧单肺通气,健侧90°卧位。手术采用单操作孔45例:第7或8肋间腋后线作为观察孔长约1 cm;操作孔在腋前线与锁骨中线间第4或第5肋间,长约3~5 cm;两操作孔71例,在肩胛下角线,第8或9肋间加一长约辅助操作孔1 cm。电视胸腔镜采用史塞克30°镜,使用电凝钩、超声刀进行分离、解剖肺门结构,内镜直线切割缝合器处理血管、支气管和叶间裂,完成解剖性肺叶切除,使用电凝钩、超声刀行系统淋巴结清扫术。完成左上肺切除33例(其中1例为左上肺叶切除并左下肺叶局部切除)、左下肺切除21例、右上肺切除30例、右中肺叶切除8例、右下肺切除24例。
1.3 术后随访
入组患者术后建立完整资料档案。对术后分期Ⅰb期以上患者给予第3代铂类药物为基础的化疗方案,治疗4周期。术后一年每3月复查一次,以后每6月复查一次,随访方式采取来院复查、电话或信件进行。
1.4 统计学方法
所有资料采用SPSS17.0软件进行统计学处理,数据采用百分率、均数±标准差(x±s)表示。采用Kaplan-Meier生存曲线对生存率进行分析。P < 0.05为差异有统计学意义。
2 结果
本组无围术期死亡。手术时间64~276 min。出血量60~560 ml,2例肺血管分支出血,经纱布压迫、镜下缝合止血。11例患者围术期发生并发症,其中肺漏气2例、肺部感染1例、肺膨胀不全和肺不张4例、心律失常1例、皮下气肿3例,均经对症治疗后治愈。术后住院时间5~12天。清扫各组淋巴结12~31枚,淋巴结站数(5.6±1.2),主要为第4、5、6、7、10、11组淋巴结。术后病理诊断,见表 1。
表 1 术后病理诊断及分期Table 1 Postoperative pathological diagnosis and stage
随访截至2015年8月,平均随访时间4~69月,随访期间共死亡11例,4例失访(失访计入死亡)。Kaplan-Meier生存统计分析,Ⅰ、Ⅱ、Ⅲ期非小细胞肺癌患者术后5年生存率分别为77.6%、42.4%、20.8%,见图 1。
3 讨论
鉴于传统开胸术式给患者造成极大的痛苦[1],电视胸腔镜肺叶切除术肺癌根治术自20世纪90年代以来发展迅速,随着经验积累和技术进步已在全世界范围内得到广泛应用,其诸多优势已经充分得到肯定,是安全、可靠的手术方式之一。我们对116例非小细胞肺癌患者采用电视胸腔镜肺叶切除术及系统淋巴结清扫术(SLND)治疗,效果良好,平均住院时间缩短、术中出血量少、炎性反应轻、术后并发症少、术后疼痛发生率低。当然,开展初期,手术时间相对较长,随着手术例数的增多及对该技术的熟练掌握,目前平均手术时间(123.1±51.0)min(64~276 min),而且手术方式也从三孔逐步过渡到两孔(单操作孔)。目前,国内外许多学者已进行单孔肺叶切除及淋巴结清扫,Feng等[2]报道一组54例单孔胸腔镜肺叶切除,认为单孔胸腔镜肺叶切除肺癌根治、淋巴结清扫是一种安全有效的手术技术,而手术器械的进步和外科技术的改良有助于该技术的提高。
胸腔镜手术并发症发生率较低。本组患者术后常见并发症有肺漏气、出血、肺部感染、肺不张、心律失常和皮下气肿等,共11例,占9.48%,经对症处理全部治愈。Wang[3]报道一组胸腔镜手术结果,总的术后30日内并发症发生率,胸腔镜组较开放组显著降低,而术后30日并发症发生率较开放组有下降趋势但无显著性差异,胸腔镜组住院时间明显缩短,Kaplan-Meier生存分析显示5年的无疾病生存和总生存率相似。
胸腔镜肺叶切除术的患者机体功能恢复快[4]、术后辅助化疗耐受性好[5]。日本一项比较胸腔镜与开胸手术预后及化疗耐受性的研究结果提示,胸腔镜术后并发症较低并且更有益于患者接受全程足量的化疗(腔镜组和开胸组的化疗率:(84.2% vs. 65.8%, P=0.032))[6],本组对术后分期Ⅰb期以上的患者给予第3代铂类药物为基础的化疗方案,治疗4周期,耐受性好。
胸腔镜肺叶切除手术对高龄、肺功能低的患者[7-8]具有显著优势。Oparka等[9]研究发现对限制性肺通气障碍患者,FEV1预计值 < 60%,胸腔镜肺部并发症明显低于开放手术(P=0.023),肺炎发生率减少(4.3% vs. 21.7%, P < 0.05),重症监护时间缩短(2天vs. 4天, P=0.05),住院时间缩短(7天vs. 10天, P=0.058);而比较FEV1 < 40%患者术后复发和生存结果显示,胸腔镜解剖性肺段切除较开胸肺段切除的住院时间缩短(8天vs. 12天, P=0.054),而5年生存率明显延长(42% vs. 18%, P=0.02)。本组年龄最大的1例患者82岁,右下肺内基底段肿物3.5 cm×3.0 cm,部分肺不张,经皮CT引导下穿刺证实鳞状细胞癌,术前FEV1仅52%(2.1升),考虑到术前局限肺不张,通气血流比有失调,术后肺功能则有可能改善,而肿物较大不能行肺段切除,故行单孔右下肺叶切除,淋巴结清扫,术后经呼吸道管理、呼吸功能锻炼等围手术期处理,恢复顺利,无明显并发症发生,氧饱和度可达95%,术后病理T2N0M0(Ⅰb期),术后未进行任何辅助治疗,目前已随访28月,未见肿瘤复发,生活质量较高。我们认为胸腔镜肺叶切除操作能够减少对健肺的揉捏,刺激少、炎性反应轻;而胸腔镜微小的创伤可减轻术后疼痛,有利于咳嗽、余肺膨胀,使肺功能快速恢复。
关于淋巴结清扫,胸腔镜手术由于镜头能够达到胸腔内的各个部位,视野更清楚,因此对淋巴结的清扫具有独到的优势。本组清扫各组淋巴结12~31枚,淋巴结站数(5.6±1.2),符合肺癌根治标准。Zhang等[10]在一项电视辅助胸腔镜手术(video-assisted thoracoscopic surgery, VATS)和开放手术比较研究中对淋巴结清扫和淋巴结采样,全身和局部复发率和长期生存率的Meta分析提示,两组中总的淋巴结清扫或淋巴结采样与纵隔淋巴结清扫或采样数无显著性差异,但胸腔镜组的全身性或局部复发率明显降低。该研究提示在早期非小细胞肺癌中,胸腔镜在降低复发率和提高生存率上是一种可替代传统开胸手术的正确合适的选择。
淋巴结清扫是影响术后疗效的主要因素,Merritt等[11]研究发现,开放组的淋巴结清扫平均数明显高于腔镜组,开放组中24.6%的患者淋巴结从术前的N0期升至术后的N1或N2期,而腔镜组仅占10%(P=0.05),两组Kaplan-Meier 3年生存率相似。虽然淋巴结升期并未能转化为3年生存率的提高,但笔者认为在胸腔镜手术中应该更加充分地清扫淋巴结。Licht等[12]的一项Ⅰ期NSCLC研究结果也发现腔镜组的淋巴结升期率要低于开放组,而同样多因素生存分析提示两组生存率无显著性差异。另外,淋巴结处理也是胸腔镜中转开胸主要影响因素[13],胸腔镜手术过程中处理困难淋巴结可增加手术时间、增加失血量、术后恢复时间延长,因此,选择正确及时的中转开胸可以减少以上危害。
远期生存质量是评价一种手术方式是否合理的最重要标准。Murakawa等[14]认为,胸腔镜手术在手术时间、出血量、置管时间和住院时间上要优于开放手术,但生存期预后方面与开放手术基本相差不大。Cao等[15]报道一组标准的胸腔镜肺叶切除与传统开胸手术有相似的远期生存效果。Yamamoto等[16]报道325例电视胸腔镜肺叶切除术治疗原发性肺癌,随访时间超过5年,平均随访66月,全组患者5年总体生存率和无病生存率在各分期分别为:Ⅰa期85%和83%、Ⅰb期69%和64%、Ⅱ期48%和37%、Ⅲ期29%和19%。这些数据不次于国际公认的开胸手术生存率。本组116例非小细胞肺癌胸腔镜肺叶切除及系统淋巴结清扫术患者中,有112例完成了随访,平均随访时间4~69月,Ⅰ、Ⅱ、Ⅲ期非小细胞肺癌患者术后5年生存率分别为77.6%、42.4%、20.8%,与上述报道结果相类似。
本组116例胸腔镜肺叶切除手术经验进一步证实了该手术是一种安全、可靠的手术方式,可完成解剖意义上的肿瘤彻底切除和淋巴结清扫,已经成为肺部肿瘤外科治疗的标准手术术式之一。相信随着手术器械的改进和技术的提高,手术适应证范围将继续扩大,并发症发生率会进一步降低,肺癌患者术后的生存率将进一步提高。
Competing interests: The authors declare that they have no competing interests.作者贡献:高冠论、周璇:课题设计、资料分析、撰写论文许娜、魏婷:数据统计分析与修改核对刘晓力、李庆山:拟定写作思路、指导论文撰写与修改 -
表 1 ASS基因缺失组和非缺失组CML患者临床基线资料比较
Table 1 Comparison of clinical baseline date of patients with CML in ASS gene deletion and non-deletion groups

表 2 ASS基因缺失组和非缺失组CML患者各时点遗传学反应疗效比较
Table 2 Comparison of therapeutic effects of genetic responses among patients with CML in ASS gene deletion and nondeletion groups at each time point

-
[1] Jabbour E, Kantarjian H. Chronic myeloid leukemia: 2020 update on diagnosis, therapy and monitoring[J]. Am J Hematol, 2020, 95(6): 691-709. doi: 10.1002/ajh.25792
[2] Chandran RK, Geetha N, Sakthivel KM, et al. Prognostic Implications of Derivative Chromosome 9 Deletions in Patients with Advanced-Stage Chronic Myelogenous Leukemia[J]. J Environ Pathol Toxicol Oncol, 2018, 37(2): 117-126. doi: 10.1615/JEnvironPatholToxicolOncol.2018026023
[3] Asnafi AA, Deris Zayeri Z, Shahrabi S, et al. Chronic myeloid leukemia with complex karyotypes: Prognosis and therapeutic approaches[J]. J Cell Physiol, 2019, 234(5): 5798-5806. doi: 10.1002/jcp.27505
[4] Li JY, Xu W, Wu W, et al. The negative prognostic impact of derivative 9 deletions in patients who received hydroxyurea treatment for chronic myelogenous leukemia in the chronic phase[J]. Onkologie, 2008, 31(11): 585-589.
[5] 中华医学会血液学分会. 中国慢性髓性白血病诊断与治疗指南(2016年版)[J]. 中华血液学杂志, 2016, 37(8): 633-639. https://xuewen.cnki.net/CCND-YIYA201610190061.html Chinese Society of Hematology, Chinese Medical Association. The guidelines for diagnosis and treatment of chronic myelogenous leukemia in China (2016 edition)[J]. Zhonghua Xue Ye Xue Za Zhi, 2016, 37(8): 633-639. https://xuewen.cnki.net/CCND-YIYA201610190061.html
[6] Deininger MW, Shah NP, Altman JK, et al. Chronic Myeloid Leukemia, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw, 2020, 18(10): 1385-1415. doi: 10.6004/jnccn.2020.0047
[7] Zhou T, Medeiros LJ, Hu S. Chronic Myeloid Leukemia: Beyond BCR-ABL1[J]. Curr Hematol Malig Rep, 2018, 13(6): 435-445. doi: 10.1007/s11899-018-0474-6
[8] Zhang H, Liu M, Wang X, et al. Genomic Copy Number Variants in CML Patients With the Philadelphia Chromosome (Ph+): AnUpdate[J]. Front Genet, 2021, 12: 697009. doi: 10.3389/fgene.2021.697009
[9] 张朕豪, 王艳芳, 王淼, 等. 应用三色双融合探针检测BCR-ABL融合基因及ASS1基因缺失[J]. 中国实验血液学杂志, 2020, 28(4): 1115-1122. doi: 10.19746/j.cnki.issn1009-2137.2020.04.006 Zhang ZH, Wang YF, Wang M, et al. [Detection of BCR/ABL Fusion Gene and ASS1 Gene Deletion by Using Tricolor Dual-fusion Probe[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2020, 28(4): 1115-1122. doi: 10.19746/j.cnki.issn1009-2137.2020.04.006
[10] Fourouclas N, Campbell PJ, Bench AJ, et al. Size matters: the prognostic implications of large and small deletions of the derivative 9 chromosome in chronic myeloid leukemia[J]. Haematologica, 2006, 91(7): 952-955
[11] Egan D, Radich J. Making the diagnosis, the tools, and risk stratification: More than just BCR-ABL[J]. Best Pract Res Clin Haematol, 2016, 29(3): 252-263. doi: 10.1016/j.beha.2016.10.015
[12] Fernandes A, Shanmuganathan N, Branford S. Genomic Mechanisms Influencing Outcome in Chronic Myeloid Leukemia[J]. Cancers (Basel), 2022, 14(3): 620. doi: 10.3390/cancers14030620
[13] Hochhaus A, Baccarani M, Silver RT, et al. European leukemianet 2020 recommendations for treating chronic myeloid leukemia[J]. Leukemia, 2020, 34: 966-984. doi: 10.1038/s41375-020-0776-2
[14] Hochhaus A, Larson RA, Guilhot F, et al. Long-Term Outcomes of Imatinib Treatment for Chronic Myeloid Leukemia[J]. N Engl J Med, 2017, 376(10): 917-927. doi: 10.1056/NEJMoa1609324
[15] Gorusu M, Benn P, Li Z, et al. On the genesis and prognosis of variant translocations in chronic myeloid leukemia[J]. Cancer Genet Cytogenet, 2007, 173(2): 97-106. doi: 10.1016/j.cancergencyto.2006.10.006
[16] 董洁, 李薇, 白晶, 等. 9号衍生染色体在慢性粒细胞白血病预后评估中的意义[J]. 吉林大学学报(医学版), 2016, 42(2): 301-305. https://www.cnki.com.cn/Article/CJFDTOTAL-BQEB201602021.htm Dong J, Li W, Bai J, et al. Significance of derivative chromosome 9 in evaluation on prognosis of chronic myeloid leukemia[J]. Jilin Da Xue Xue Bao(Yi Xue Ban), 2016, 42(2): 301-305. https://www.cnki.com.cn/Article/CJFDTOTAL-BQEB201602021.htm
[17] Kim DH, Popradi G, Sriharsha L, et al. No significance of derivative chromosome 9 deletion on the clearance kinetics of BCR/ABL fusion transcripts, cytogenetic or molecular response, loss of response, or treatment failure to imatinib mesylate therapy for chronic myeloid leukemia[J]. Cancer, 2008, 113(4): 772-781. doi: 10.1002/cncr.23607
[18] Švabek ŽT, Josipović M, Horvat I, et al. The incidence of atypical patterns of BCR-ABL1 rearrangement and molecular-cytogenetic response to tyrosine kinase inhibitor therapy in newly diagnosed cases with chronic myeloid leukemia (CML)[J]. Blood Res, 2018, 53(2): 152-159. doi: 10.5045/br.2018.53.2.152
[19] Quintás-Cardama A, Kantarjian H, Shan J, et al. Prognostic impact of deletions of derivative chromosome 9 in patients with chronic myelogenous leukemia treated with nilotinib or dasatinib[J]. Cancer, 2011, 117(22): 5085-5093. doi: 10.1002/cncr.26147
[20] Bennour A, Ouahchi I, Ben Youssef Y, et al. Molecular cytogenetic study of derivative chromosome 9 deletion in chronic myeloid leukemia patients[J]. Med Oncol, 2012, 29(2): 1151-1160. doi: 10.1007/s12032-011-9918-8
[21] Jiang Y, Zhang J, Guo D, et al. Entire ABL1 Gene Deletion Without BCR/ABL1 Rearrangement in a Female Patient with B-Cell Precursor Acute Lymphoblastic Leukemia[J]. Onco Targets Ther, 2020, 13: 783-790. doi: 10.2147/OTT.S238336
[22] Bennour A, Sennana H, Laatiri MA, et al. Molecular cytogenetic characterization of variant Philadelphia translocations in chronic myeloid leukemia: genesis and deletion of derivative chromosome 9[J]. Cancer Genet Cytogenet, 2009, 194(1): 30-37. doi: 10.1016/j.cancergencyto.2009.05.010
[23] Kreil S, Pfirrmann M, Haferlach C, et al. Heterogeneous prognostic impact of derivative chromosome 9 deletions in chronic myelogenous leukemia[J]. Blood, 2007, 110(4): 283-1290.
[24] 李珍, 张龑莉, 赵慧芳, 等. 伊马替尼联合三氧化二砷治疗伴有ASS基因缺失的Ph+慢性粒细胞白血病的临床研究[J]. 中国实用医刊, 2019, 46(11): 97-99. https://www.cnki.com.cn/Article/CJFDTOTAL-HBZY201812008.htm Li Z, Zhang YL, Zhao HF, et al. Effects of imatinib combined arsenic trioxide on Ph+chronic myeloid leukemia patients lacking of ASS genes[J]. Zhongguo Shi Yong Yi Kan, 2019, 46(11): 97-99. https://www.cnki.com.cn/Article/CJFDTOTAL-HBZY201812008.htm



 下载:
下载: