Effects of Tspan8 Gene Knockout Combined with Anlotinib on Proliferation, Migration, Invasion and Apoptosis of Colon Cancer SW480 Cells
-
摘要:目的
探讨Tspan8基因敲除联合安罗替尼对结肠癌SW480细胞增殖、迁移、侵袭和凋亡的影响。
方法采用CRISPR/Cas9技术构建质粒并敲除SW480细胞的Tspan8基因,Western blot法检测敲除效果。采用MTT法计算安罗替尼的半数抑制浓度(IC50)。实验分为对照组、安罗替尼组、Tspan8敲除组和联合组。采用细胞增殖实验、克隆形成实验、划痕实验、Transwell小室法和流式细胞术检测各组细胞的增殖、迁移、侵袭和凋亡情况;Western blot法检测安罗替尼对SW480细胞中Tspan8表达水平的影响。
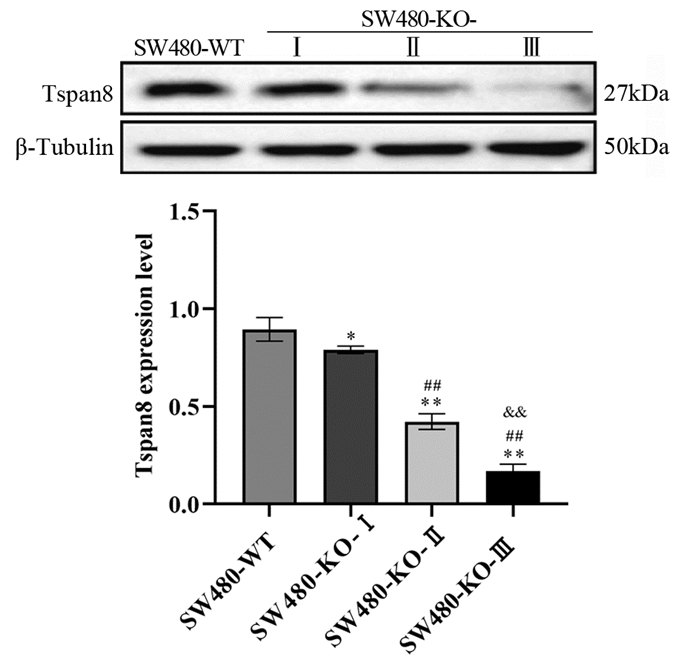
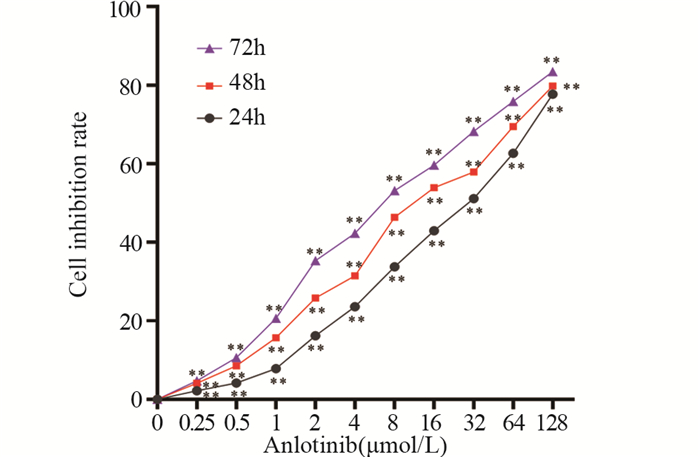
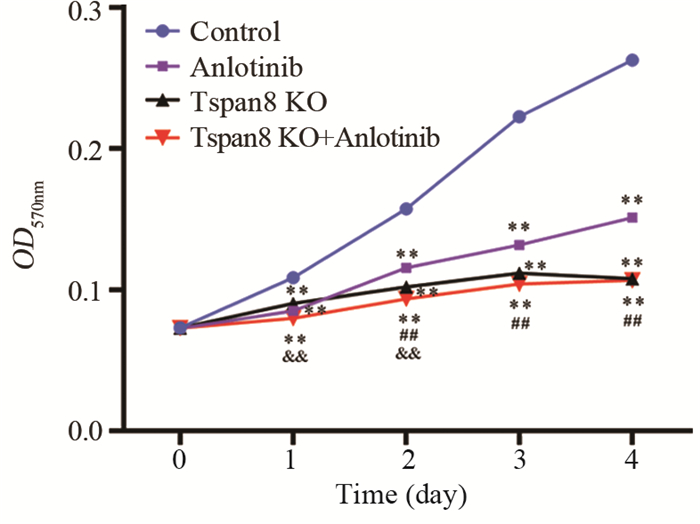
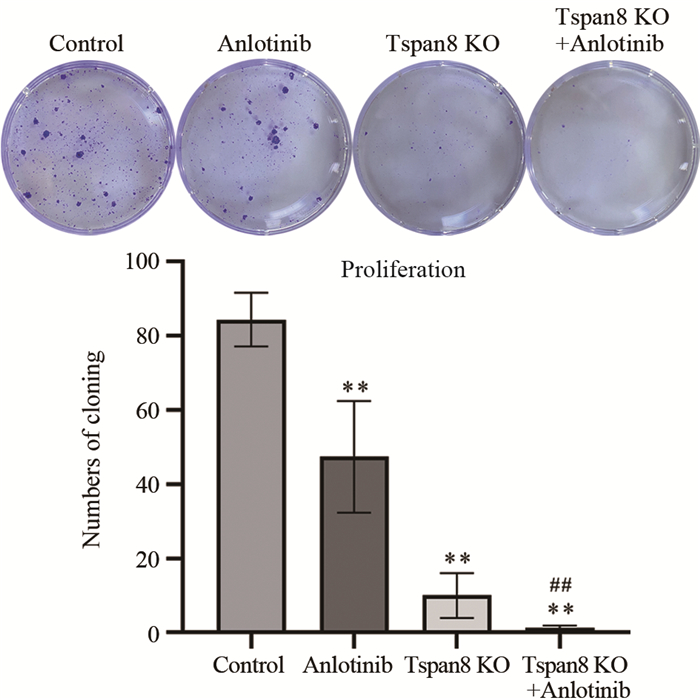
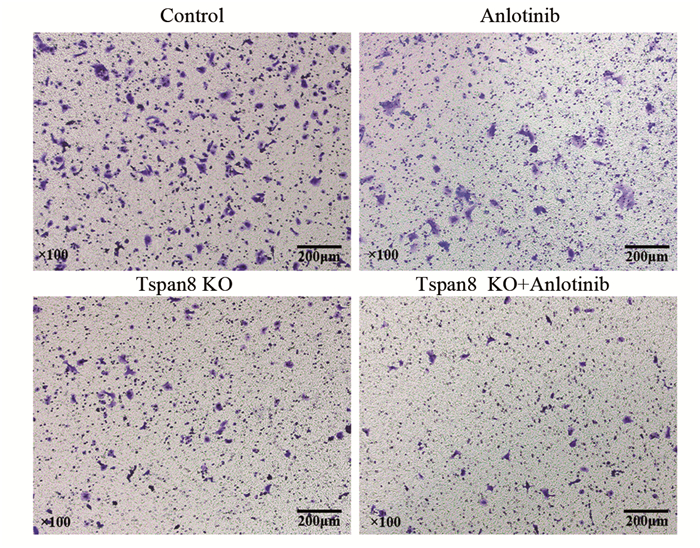
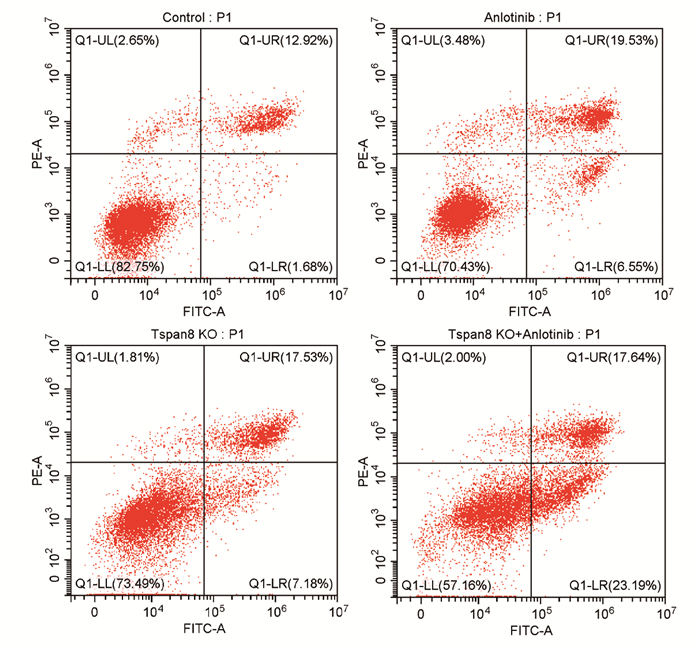
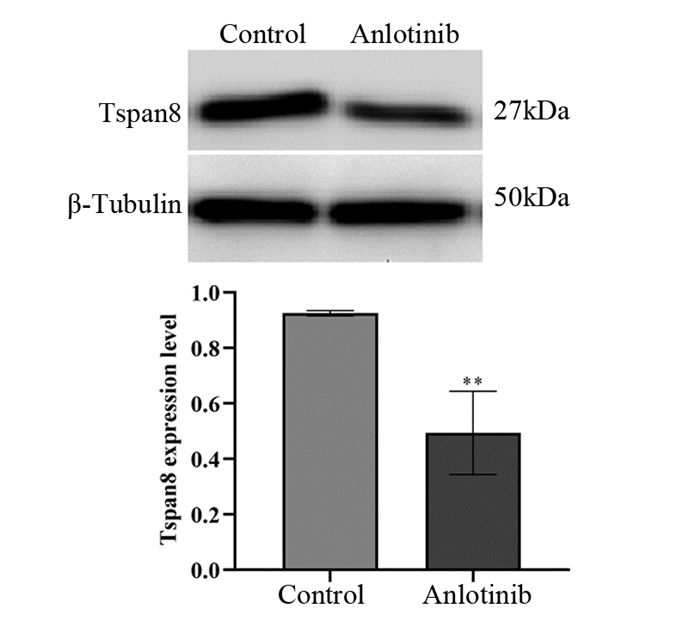
结果在Tspan8敲除组中,SW480-KO-Ⅲ细胞的敲除效率最高,用于后续实验。不同浓度的安罗替尼在不同作用时间均能抑制SW480细胞的增殖(P < 0.01),且呈浓度依赖性和时间依赖性(P < 0.01),根据IC50选择14 μmol/L为后续实验浓度。与对照组相比,安罗替尼组、Tspan8敲除组和联合组的细胞增殖、迁移及侵袭能力显著降低,细胞凋亡水平明显提高(P < 0.05),且联合组的上述变化较安罗替尼组或Tspan8敲除组更为显著(P < 0.05)。与对照组相比,安罗替尼组SW480细胞的Tspan8表达水平明显下降(P < 0.01)。
结论Tspan8基因敲除联合安罗替尼能协同抑制SW480细胞增殖、迁移、侵袭,并促进其凋亡。
Abstract:ObjectiveTo investigate the effects of Tspan8 gene knockout combined with anlotinib on the proliferation, migration, invasion, and apoptosis of colon cancer SW480 cells.
MethodsThe plasmid was constructed by CRISPR/Cas9 technique, and Tspan8 gene was knocked out in SW480 cells. The knockout effect was detected by Western blot. The IC50 of anlotinib was calculated by MTT assay. The experiment was divided into control group, anlotinib group, Tspan8 knockout group, and combined group. Cell proliferation, migration, invasion, and apoptosis were detected by cell proliferation assay, clonal formation assay, scratch assay, Transwell chamber assay, and flow cytometry. Western blot was used to detect the effect of anlotinib on Tspan8 expression in SW480 cells.
ResultsSW480-KO-Ⅲ cells had the highest knockout efficiency in the Tspan8 knockout group. They were used in subsequent experiments. Different concentrations of anlotinib could inhibit the proliferation of SW480 cells at different times (P < 0.01) in a concentration-dependent and time-dependent manner (P < 0.01). According to IC50, 14 μmol/L was selected as the subsequent experimental concentration. Compared with those in the control group, the cell proliferation, migration, and invasion abilities in the anlotinib group, Tspan8 knockout group, and combined group were significantly decreased, and the cell apoptosis level was significantly increased (P < 0.05). The above changes in the combined group were more significant than those in the anlotinib group or Tspan8 knockout group (P < 0.05). Compared with that in the control group, the expression level of Tspan8 in SW480 cells in the anlotinib group was significantly decreased (P < 0.01).
ConclusionTspan8 gene knockout combined with anlotinib can synergistically inhibit the proliferation, migration and invasion of SW480 cells. This combination can also promote the apoptosis of these cells.
-
Key words:
- Colon cancer /
- Anlotinib /
- Tspan8 /
- Cell proliferation /
- Cell invasion
-
0 引言
声动力疗法(sonodynamic therapy, SDT)是在光动力疗法(photodynamic therapy, PDT)基础上发展而来,由Yumita等[1]于1989年提出。SDT具有很强的生物组织穿透能力,能将声能聚集到更深层的组织中,并激活某些声敏剂和光敏剂(photosensitizers, PSs),从而起到抗肿瘤的作用。SDT的抗肿瘤作用机制很多,主要包括超声空化、活性氧(reactive oxygen species, ROS)引起细胞损伤诱导细胞凋亡和自噬等[2]。热疗(hyperthermia, HT)是继手术、放疗、化疗等方法外的又一肿瘤治疗手段,其基本原理是利用各种物理能量在人体组织中产生热效应,使肿瘤细胞局部温度升高至有效治疗温度并维持一定时间,利用正常细胞和肿瘤细胞之间的温度耐受性差异,达到杀死肿瘤细胞同时避免破坏正常组织的目的。已有研究证明SDT和HT联合应用抗癌效果显著[3]。而SDT和HT各自的抗癌作用和机制并未被系统性阐述。因此,有必要对SDT和HT抗肿瘤作用及其机制进行归纳研究,为抗肿瘤治疗提供新的思路。同时,近年在探索新型纳米材料的过程中,国内外学者研究发现了一些纳米复合材料可以在体内同时进行SDT和HT,这使肿瘤治疗中SDT和HT的联合应用成为可能。本文就SDT和HT的抗癌机制以及SDT联合HT在抗肿瘤方面的应用进行综述。
1 声动力疗法
“声动力治疗”一词通常用于非热相关的超声治疗应用,包括诱导细胞凋亡、联合化疗、超声基因治疗等。最初由Yumita和Umemura发现超声波激活光敏材料可用于癌症治疗[4]。SDT是利用声敏剂和低强度超声(US)结合治疗恶性肿瘤的一种新型治疗方法,具有准确性高、组织穿透深度深、患者依从性好、不良反应小等优点。超声波可以穿透深部组织并聚焦于肿瘤区域,从而激活声敏剂,为靶向非侵入性根治实体肿瘤提供了可能。SDT的治疗机制包括空化效应、ROS的产生和热疗破坏[5]。
1.1 空化效应
声敏剂有助于产生空化效应。空化效应是一种物理现象,是指液体的微气核空化泡在一定的超声辐照作用下发生冲击、膨胀、收缩和内爆的动态过程[6]。空化效应的机制非常复杂,它们与气体振荡密切相关。在US的辐照下,液体中的气体通过压缩和减压循环振荡,产生微束和辐射力。振荡通过干扰相邻的细胞表面和细胞膜,增加了药物的穿透和扩散。稳定空化导致气泡振荡,加速周围液体的流动,导致周围介质的混合,惯性空化导致气泡扩大直到接近共振大小,并在崩溃前膨胀到最大尺寸[7]。当气泡因暴露在超声而迅速坍塌时,惯性空化导致能量被释放,进而导致细胞因高温和高压而坏死。空化微气泡的崩塌会产生强烈的冲击波,导致细胞的机械损伤和破坏。
1.2 活性氧的产生
一般认为SDT的主要机制是通过空化或空化激活的声敏剂来产生ROS。ROS是超声空化气泡塌陷的重要产物并且可以导致癌细胞死亡。除了空化效应,热解效应和声致发光等也会产生大量的ROS,产生的ROS能有效破坏细胞内蛋白质,损伤DNA,促进细胞内脂质过氧化,进一步诱导肿瘤细胞凋亡,达到抑制肿瘤生长的目的。有研究发现,当声敏剂和超声波同时处理癌细胞时,细胞表面的微绒毛结构消失,细胞膜上出现空泡,细胞萎缩,细胞骨架改变[8]。声动力治疗后,肿瘤细胞凋亡/坏死率明显升高,主要通过半胱天冬酶(caspase)依赖性凋亡通路起作用[9]。同时,进行SDT处理后细胞内线粒体功能丧失并出现了明显的脂质过氧化和抗氧化酶下调的特征[10]。
1.3 热疗破坏
US介导的另一种治疗机制是组织热效应,即通过提高组织温度破坏肿瘤组织。US机械能的吸收和转化诱导了超声波在组织传播过程中产生热能,导致细胞坏死。SDT一般使用US作为激发源,通过空化、声致发光、热解等方式产生ROS,进而导致细胞凋亡。同时,SDT的机械损伤和热损伤能进一步导致细胞坏死[11]。
2 热疗法
热疗是对病变部位进行加热处理以获得治疗效果的疗法。大量基础研究和临床应用证明,当肿瘤组织被持续加热一定时间后,肿瘤细胞生长受阻、解体以致死亡。肿瘤热疗法的形成基于两个肿瘤组织特征:一是肿瘤组织内的血管少,血流量小,一般仅为正常组织的2%~15%,因此其散热性极差,通过适当方法进行局部加热,很容易使肿瘤组织的温度比周围正常组织高5%~15%;二是肿瘤组织的耐温性明显低于正常组织,肿瘤组织在42℃的温度下就会发生不可逆损伤,而正常组织却可耐温到45℃[12]。
目前在热疗中,多采用局部加热的方案,热源通常来自微波、射频电磁波及超声波等。HT能够触发促进细胞存活和诱导细胞凋亡等多种信号通路。因此,了解HT诱导细胞凋亡的潜在机制具有重要意义。HT通过诱导caspases依赖性细胞凋亡途径从而诱导癌细胞的死亡,而caspases依赖性的细胞凋亡主要通过下列两条途径引发。
2.1 内源-线粒体起始途径
caspase-2在热应激诱导的细胞死亡中发挥重要作用。最近报道表明,在进行HT处理后,caspase-2与其适配蛋白RAIDD立即形成复合物,进而激活caspase-2并剪切Bid,随后tBid改变线粒体外膜通透性、刺激细胞色素C(cyt, C)的释放以及Apaf-1-caspase-9凋亡复合体的形成[13-14],进一步导致caspase-9酶原发生自剪切而活化,激活下游的caspases级联反应,引发细胞凋亡。
也有研究表明,热刺激本身会诱发Bcl-2蛋白家族成员Bax/Bak发生构象变化,促进细胞凋亡[15],在HT处理后,BH3亚家族成员Bim会激活Bax/Bak,参与caspase-2-Bid途径发挥相同的功能[16]。
2.2 外源-死亡受体起始途径
除了内源途径外,HT还通过激活细胞表面死亡受体来参与细胞凋亡的外源途径。死亡受体可以传递由特异性配体,如Fas配体、肿瘤坏死因子诱导凋亡配体(TRAIL)和肿瘤坏死因子(TNF-α)诱发的凋亡信号。
死亡受体如Fas在其配体FasL的刺激下发生构象变化,暴露Fas相关死亡结构域,通过细胞凋亡接头分子(Fas-associated death domain protein, FADD)招募caspase-8酶原到细胞膜上,形成死亡诱导信号复合物(death-inducing signaling complex, DISC)。caspase-8酶原在复合物中活化后进一步活化caspase-3酶原,产生有活性的caspase-3,导致细胞凋亡。而活化的caspases-8也可以切割促凋亡Bcl-2家族成员Bid,激活内源凋亡途径[17]。而死亡配体TRAIL与其死亡受体TRAIL-R1(DR4)和TRAIL-K2(DR5)结合,TNF-α与其受体TNFR1和TNFR2结合后,也能引发类似的凋亡信号传递过程[18]。
已经有研究人员发现,44℃ HT作用U937细胞(人组织淋巴瘤细胞)20 min可提高Fas的表达,同时激活caspase-8和caspase-3[19];42℃轻度HT作用Jurkat细胞30 min可以激活caspase-8[20],表明热应激确实影响了Fas受体下游的信号通路。
此外,也有报告称HT通过在内质网中积累未折叠或错误折叠的蛋白质而触发内质网应激,从而引起细胞死亡[21]。
3 声动力疗法联合热疗法的新进展
近年来,联合治疗已成为有效杀灭肿瘤细胞的重要策略,可显著提高治疗效果,降低不良反应。SDT在肿瘤治疗中显示出了巨大的潜力,具有安全性高、穿刺深度深、成本低等优点,是一种较好的非侵入性治疗各种深部肿瘤的方法。而且可以精准聚焦肿瘤区域,靶向激活声敏剂,选择性杀伤肿瘤细胞,最大限度地减少对邻近正常脏器和组织的损害,使其在治疗深部恶性肿瘤方面具有良好的治疗效果。
HT也是一种有着广泛前景的肿瘤治疗方法,单独使用时抗肿瘤作用较弱,但联合使用可以提高声动力疗法治疗肿瘤的疗效[22],已经有研究表明HT在SDT诱导线粒体功能障碍的凋亡途径中起促进作用[21],从而增强肿瘤抑制作用。热应激可引起细胞内ROS的爆炸,并可直接导致细胞凋亡。
当SDT联合HT时,在特定温度和时间的作用下,HT在体内外均能增强促凋亡蛋白的表达,激活caspases级联反应,抑制抗凋亡蛋白的表达,从而促进SDT诱导肿瘤细胞凋亡[23]。以上研究结果为SDT-HT联合疗法提供了重要的理论依据,并进一步证明SDT-HT联合疗法具有潜在的临床应用前景。下面将介绍SDT-HT联合疗法研究领域的最新进展。
3.1 声动力结合聚焦超声诱导热疗法
SDT和超声诱导热疗(SHT)相结合可以为治疗肿瘤提供一种有效的方法,这对于深部肿瘤组织的非侵入性治疗尤其有利。Chen等开发了一种新型的纳米载体——介孔二氧化硅(MSN)[24],它附着在还原的氧化石墨烯纳米片(nrGO,作为SHT增强剂)上,表面覆盖着玫瑰红(RB,一种声敏剂)聚乙二醇偶联的氧化铁纳米颗粒(离子),形成了nrGO@MSN-ion-PEG-RB,它具有SDT/SHT结合效应和磁导航功能,可以增强肿瘤组织中目标部位的局部积聚,从而实现肿瘤组织的精确治疗效果。nrGO@MSN-ion-PEG-RB可降低空化阈值,增强声动力效应,提高聚焦超声(focused ultrasound, FUS)辐照下超声诱导的热效应,相比对照组,SDT联合SHT经FUS照射可有效杀灭远离皮肤的深部肿瘤细胞。随着对癌症治疗方法的不断探索,研究人员发现,适度的热效应可以通过提高光敏反应率和缓解肿瘤缺氧来提高PDT的疗效[25]。由此可推测,融合诱导的中度热效应与SDT同时进行,可实现肿瘤治疗的协同强化。基于这一假设,Wan等制备了含有Mn2+、Ce6和人血清白蛋白(HSA)的纳米组件,以评估FUS诱导的中温(42℃)对胶质母细胞瘤增强的SDT效应[26]。体外细胞和体内治疗结果都证明了这些纳米组件对FUS照射的协同增强效应。研究表明,在纳米组件+FUS(42℃)治疗组中,既完全抑制了皮下肿瘤,又大大提高了对原位小鼠模型的抗肿瘤效果。这种二合一的治疗策略为FUS诱导的癌症治疗提供了新的视角,显示了巨大的临床应用潜力。
3.2 声动力疗法结合磁热疗法
磁热疗法(magnetic hyperthermal therapy, MHT)是一种利用磁性纳米粒子(如Fe3O4),通过交变磁场(alternating magnetic field, AMF)将磁能转化为热能的技术[27]。与被广泛研究的利用光产生热量杀死肿瘤的光热疗(photothermal therapy, PTT)不同,MHT可以处理各种组织的深部肿瘤,因为AMF具有出色的组织穿透能力[28]。然而,单用MHT并不能获得满意的治疗效果,因此在肿瘤治疗中常与其他治疗手段联合使用。由于MHT与SDT具有相似的高组织穿透特性,因此MHT联合SDT被认为是协同治疗癌症的新策略。
最近,Zhang等以空心Fe3O4为磁热剂,血卟啉(HP)为声敏剂构建了多功能纳米体系,实现了MHT和SDT对肿瘤的协同治疗效果[29]。这种情况下,Fe3O4不仅作为MHT的磁高温剂,而且作为一种内在的类似过氧化氢酶的纳米酶,催化H2O2原位生成O2,以克服肿瘤缺氧,并为SDT介导的ROS生成提供氧气来源。产生的ROS可以抑制热休克蛋白(heat shock proteins, HSPs)的表达,降低细胞的热耐受性,从而大大提高MHT的治疗效果。实验证明,这种相互增强的纳米体系同时克服了MHT和SDT的缺陷,并显示出协同抑制PC-3肿瘤增殖的效用。
3.3 声动力疗法结合微波热疗法
微波热疗法(microwave thermotherapy),使用温度区间在41℃和45℃之间,由于其可操作性强、产热快,引起了越来越多的关注。微波辐射对组织的穿透深度较深,对组织局部热的敏感度较低,提高了杀灭肿瘤细胞的效率。因此,它已成为与免疫治疗、化疗、放射治疗或手术治疗相结合的新一代联合治疗癌症的最有前途的技术之一。SDT联合微波热疗,可以增强免疫治疗抗肿瘤作用,因为更多的淋巴细胞被招募到肿瘤部位,分泌更多的细胞因子。
Qi等报道了一种具有pH和热双重敏感度的牛乳铁蛋白纳米粒子(HLPN),当应用在微波热疗时,该纳米粒子同时具有抗肿瘤和免疫细胞激活的作用[30]。牛乳铁蛋白被纳米粒子送到肿瘤部位后,在溶酶体的酸性环境和微波辐射引起的热条件下立即从纳米粒子中释放出来,最终通过损伤相关分子模式(DAMPs)的释放导致肿瘤凋亡。体内和体外研究表明,热疗可明显诱导肿瘤免疫原性细胞死亡(ICD),并增强DAMPs的释放。HLPN加热疗组对抗肿瘤的效果最好。实验观察到肿瘤部位淋巴细胞浸润增加,淋巴细胞增殖增强,细胞因子分泌增多,提示HLPN加微波热疗策略可引起较强的抗肿瘤免疫反应。
值得注意的是,此实验设计的pH和热双敏纳米粒子在癌症治疗中有很好的应用,微波热疗结合免疫治疗的策略为临床肿瘤治疗提供了解决方案。虽然目前还没有关于声动力疗法结合微波热疗的相关报道,但这也为我们提供了新思路,值得进一步研究。
4 小结与展望
近年来,联合应用热疗、药物治疗、光热疗法(PTT)与化疗、PTT与PDT的联合治疗已成为有效杀灭肿瘤细胞的重要策略,可显著提高治疗效果,降低不良反应。随着纳米复合材料与PSs的逐渐发展,SDT、PDT与热疗的结合也随之产生,将纳米技术与其相结合,不仅能联合热疗共同对肿瘤进行作用,还能显著增溶难溶性声敏剂,提高声敏剂的声动力活性,改善其组织分布,降低对机体的毒副作用。此外,部分纳米载体在转运药物的同时,还具有潜在的生物活性,且易于修饰,有利于实现制剂的多功能化,推动疾病的多模式诊断和治疗[31]。SDT-HT联合疗法,已被证明通过调节不同的信号通路,极大地改善了治疗效果。因此探索纳米材料辅助的SDT-HT联合疗法在临床转化方面有很大的潜力。同时也有许多挑战有待解决,目前来看,纳米技术在疾病声动力疗法中的应用还处于起步阶段,有关制剂类型的报道较少,且缺乏大量的实验数据支撑。相信不久的将来,我们可以通过建立系统的实验理论方法,扩充纳米制剂的种类,引入新兴纳米材料等手段克服重重困难,加快推进纳米技术在癌症声动力疗法中的研究,为未来进行纳米材料辅助声动力联合热疗治疗癌症的临床转化打下坚实的基础。
Competing interests: The authors declare that they have no competing interests.作者贡献:谢转红:实验设计与实施、数据采集、统计分析及解释、文章撰写许云鹏:实验设计与实施、数据采集马珲敏:实验设计王祥:实验设计、经费支持、文章修订和审校 -
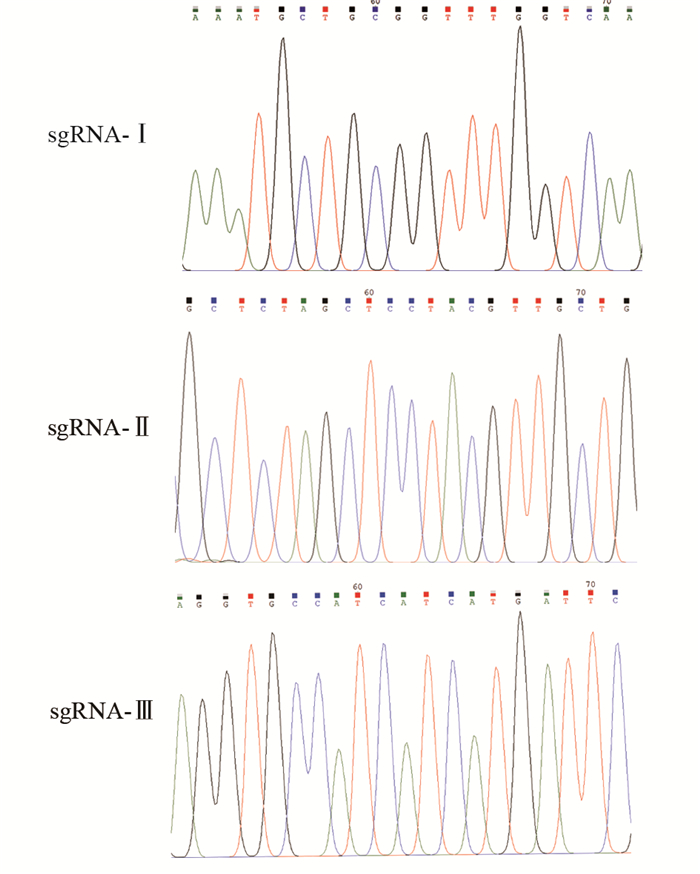
表 1 针对Tspan8的三条sgRNA序列
Table 1 Three sgRNA sequences targeting Tspan8

表 2 三对单链sgRNA引物序列
Table 2 Three pairs of single-chain sgRNA primer sequences

-
[1] SungH, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[2] Lin B, Song X, Yang D, et al. Anlotinib inhibits angiogenesis via suppressing the activation of VEGFR2, PDGFRβ and FGFR1[J]. Gene, 2018, 654: 77-86. doi: 10.1016/j.gene.2018.02.026
[3] XieC, Wan X, Quan H, et al. Preclinical characterization of anlotinib, a highly potent and selective vascular endothelial growth factor receptor-2 inhibitor[J]. Cancer Sci, 2018, 109(4): 1207-1219. doi: 10.1111/cas.13536
[4] Sun Y, NiuW, Du F, et al. Safety, pharmacokinetics, and antitumor properties of anlotinib, an oral multi-target tyrosine kinase inhibitor, in patients with advanced refractory solid tumors[J]. J Hematol Oncol, 2016, 9(1): 105. doi: 10.1186/s13045-016-0332-8
[5] Zhou M, Chen XY, Zhang H, et al. China National Medical Products Administration approval summary: anlotinib for the treatment of advanced non-small cell lung cancer after two lines of chemotherapy[J]. Cancer Commun(Lond), 2019, 39(1): 36.
[6] Han B, Li K, Wang Q, et al. Effect of Anlotinib as a Third-Line or Further Treatment on Overall Survival of Patients With Advanced Non-Small Cell Lung Cancer The ALTER 0303 Phase 3 Randomized Clinical Trial[J]. JAMA Oncol, 2018, 4(11): 1569-1575. doi: 10.1001/jamaoncol.2018.3039
[7] Cheng Y, Wang Q, Li K, et al. Anlotinib as Third-Line or Further-Line Treatment in Relapsed SCLC: A Multicenter, Randomized, Double-Blind Phase 2 Trial[J]. J Thorac Oncol, 2018(13: 10S), S351-S352.
[8] Chi Y, Fang Z, Hong X, et al. Safety and efficacy of anlotinib a multikinase angiogenesis inhibitor, in patients with refractory metastatic soft tissue sarcoma[J]. Clin Cancer Res, 2018, 24(21): 5233-5238. doi: 10.1158/1078-0432.CCR-17-3766
[9] 李娜, 黄琦, 张明军, 等. 安罗替尼三线治疗晚期转移性结直肠癌疗效分析[J]. 中华医学杂志, 2019, 99(36): 2844-2847. doi: 10.3760/cma.j.issn.0376-2491.2019.36.010 Li N, Huang Q, Zhang MJ, et al. Efficacy and safety of Anlotinib as a third-line chemotherapy for metastatic colorectal cancer[J]. Zhonghua Yi Xue Za Zhi, 2019, 99(36): 2844-2847. doi: 10.3760/cma.j.issn.0376-2491.2019.36.010
[10] Chi Y, Shu Y, Ba Y, et al. Anlotinib monotherapy for refractory metastatic colorectal cancer: a double-blinded, placebo controlled, randomized phase Ⅲ trial (alter0703)[J]. Oncologist, 2021, 26(10): e1693-e1703. doi: 10.1002/onco.13857
[11] Cheng Y, Du FC, Fang FQ, et al. Third-line treatment for metastatic colorectal cancer: anlotinib is superior to chemotherapy and similar to fruquintinib or regorafenib[J]. Neoplasma, 2020, 67(6): 1384-1390.
[12] Zhan ZY, Zhong LX, Feng M, et al. A Positive Tetraspanin 8 (TSPAN8)/β-Catenin Regulatory Loop Enhances the Stemness of Colorectal Cancer Cells[J]. Med Sci Monit, 2019, 25: 9594-9601. doi: 10.12659/MSM.919749
[13] Greco C, Bralet MP, Ailane N, et al. E-cadherin/p120-catenin and tetraspanin Co-029 cooperate for cell motility control in human colon carcinoma[J]. Cancer Res, 2010, 70(19): 7674-7683. doi: 10.1158/0008-5472.CAN-09-4482
[14] Zhu Y, Ailane N, Sala-Valdés M, et al. Multi-factorial modulation of colorectal carcinoma cells motility-partial coordination by the tetraspanin Co-029/tspan8[J]. Oncotarget, 2017, 8(16): 27454-27470. doi: 10.18632/oncotarget.16247
[15] Guo QS, Xia B, Zhang F, et al. Tetraspanin CO-029 inhibits colorectal cancer cell movement by deregulating cell-matrix and cell-cell adhesions[J]. PLoS One, 2012, 7(6): e38464. doi: 10.1371/journal.pone.0038464
[16] Zhang HS, Liu HY, Zhou Z, et al. TSPAN8 promotes colorectal cancer cell growth and migration in LSD1-dependent manner[J]. Life Sci, 2020, 241: 117114. doi: 10.1016/j.lfs.2019.117114
[17] 中华人民共和国国家卫生健康委员会. 中国结直肠癌诊疗规范(2020版)[J]. 中华消化外科杂志, 2020, 19(6): 563-588. doi: 10.3760/cma.j.cn115610-20200504-00348 National Health Commission of the People's Republic of China. Chinese protocol of diagnosis and treatment of colorectal cancer (2020 edition)[J]. Zhonghua Xiao Hua Wai Ke Za Zhi, 2020, 19(6): 563-588. doi: 10.3760/cma.j.cn115610-20200504-00348
[18] 中国临床肿瘤学会指南工作委员会. CSCO结直肠癌诊疗指南2020版[M]. 北京: 人民卫生出版社, 2020: 131. Chinese Society of Clinical Oncology Guidelines Working Committee. Guidelines ofChinese society of clinical oncology(CSCO)—Colorectal cancer[M]. Beijing: People's Medical Publishing House, 2020: 131.
[19] Lan WL, Zhao JY, Chen WJ, et al. Anlotinib overcomes multiple drug resistant of the colorectal cancer cells via inactivating PI3K/AKT pathway[J]. Anticancer Agents Med Chem, 2021, 21(15): 1987-1995. doi: 10.2174/1871520621666210112113852
[20] Yang Q, Ni LC, Saber Imani, et al. Anlotinib Suppresses Colorectal Cancer Proliferation and Angiogenesis via Inhibition of AKT/ERK Signaling Cascade[J]. Cancer Manag Res, 2020, 12: 4937-4948. doi: 10.2147/CMAR.S252181
[21] Yan LH, Zhang D, Mo SS, et al. Anlotinib suppresses metastasis and multidrug resistance via dual blockade of MET/ABCB1 in colorectal carcinoma cells[J]. J Cancer, 2021, 12(7): 2092-2104. doi: 10.7150/jca.45618
[22] Jia ZX, Zhang Z, Li Z, et al. Anlotinib inhibits the progress of colorectal cancer cells by antagonizing VEGFR/JAK2/STAT3 axis[J]. Eur Rev Med Pharmacol Sci, 2021, 25(5): 2331-2343.
[23] Wei L, Li Y, Suo Z. TSPAN8 promotes gastric cancer growth and metastasis via ERK MAPK pathway[J]. Int J Clin Exp Med, 2015, 8(6): 8599-8607.
[24] 高辉, 殷玉敬, 巴雅尔, 等. TSPAN8对肺癌A549细胞体外增殖的影响及机制[J]. 现代肿瘤医学, 2017, 25(6): 864-867. doi: 10.3969/j.issn.1672-4992.2017.06.007 Gao H, Yin YJ, Bayaer, et al. The effect of TSPAN8 on cell proliferation of human lung cancer A549 cells and the mechanisms[J]. Xian Dai Zhong Liu Yi Xue, 2017, 23(6): 864-867. doi: 10.3969/j.issn.1672-4992.2017.06.007
[25] Lv L, Mei F, Wang J. Tetraspanin 8 promotes radioresistance of human nasopharyngeal carcinoma via the activation of PI3K/AKT pathway[J]. Int J Clin Exp Med, 2016, 9(7): 12543-12552.
[26] Li L, Yang DP, Cui DJ, et al. Quantitative proteomics analysis of the role of tetraspanin-8 in the drug resistance of gastric cancer[J]. Int J Oncol, 2018, 52(2): 473-484.
[27] Lin X, Bi Z, Hu Q, et al. TSPAN8 serves as a prognostic marker involving Akt/MAPK pathway in nasopharyngeal carcinoma[J]. Ann Transl Med, 2019, 7(18): 470. doi: 10.21037/atm.2019.08.02
[28] Akiel MA, Santhekadur PK, Mendoza RG, et al. Tetraspanin 8 mediates AEG-1-induced invasion and metastasis in hepatocellular carcinoma cells[J]. FEBS Lett, 2016, 590(16): 2700-2708. doi: 10.1002/1873-3468.12268
-
期刊类型引用(1)
1. 蒋遥,温伟红,杨发,聂迪森,张武合,秦卫军. 多靶点CAR-T细胞治疗肿瘤的研究进展. 肿瘤防治研究. 2022(07): 709-714 .  本站查看
本站查看
其他类型引用(3)



 下载:
下载: