-
摘要:目的
探讨miR-581对卵巢癌SKOV3细胞自噬的影响及作用机制。
方法将miR-581 mimics和miR-581 NC转染到卵巢癌SKOV3细胞中,实时荧光定量PCR法(qRT-PCR)检测转染效率;转染成功后,Western blot检测转染后卵巢癌SKOV3细胞中自噬相关蛋白的表达水平;TargetScanHuman数据库预测miR-581靶基因,Western blot验证miR-581与靶基因的作用。
结果过表达miR-581后可显著抑制自噬相关蛋白LC3Ⅱ和Beclin1的表达(P < 0.01);miR-581可负向调控FOXO1的表达(P < 0.01);FOXO1促进卵巢癌SKOV3细胞自噬(P < 0.05)。
结论miR-581通过调控FOXO1的表达影响卵巢癌SKOV3细胞自噬。
Abstract:ObjectiveTo explore the effect and mechanism of miR-581 on the autophagy of ovarian cancer SKOV3 cells.
MethodsmiR-581 mimics and miR-581 NC were transfected into SKOV3 cells, and the transfection efficiency was detected by qRT-PCR. After successful transfection, Western blot was used to detect autophagy-related proteins expression in SKOV3 cells. TargetScanHuman database predicted miR-581 target genes, and Western blot verified the role of miR-581 and target genes.
ResultsOverexpression of miR-581 significantly inhibited the expression of autophagy-related proteins LC3 Ⅱ and Beclin1 (P < 0.01); miR-581 negatively regulated FOXO1 expression (P < 0.01) and FOXO1 promoted autophagy of SKOV3 cells (P < 0.01).
ConclusionmiR-581 affects the autophagy of ovarian cancer SKOV3 cells by regulating the expression of FOXO1.
-
Key words:
- Ovarian cancer /
- SKOV3 cells /
- Autophagy /
- miR-581 /
- FOXO1
-
0 引言
卵巢癌是女性生殖系统最常见的恶性肿瘤,具有隐匿性,严重威胁女性健康。尽管卵巢癌的治疗效果在细胞减灭术和化疗方面有所改善,但常在癌症晚期被诊断为转移和化疗耐药,5年总存活率不到30%[1]。自噬是真核细胞中高度保守的生物学行为,可在缺氧、饥饿或极端pH值等条件下激发,分解细胞不必要或丧失功能的成分,一旦缺失或过度激活则可能引起一系列病理改变[2]。研究证实,多种肿瘤的发生、发展及耐药都与自噬有着密不可分的联系。在卵巢癌中,自噬水平下调,促进自噬有助于抑制卵巢癌的发展[3]。自噬在卵巢癌SKOV3细胞中的发生机制仍未阐明,亟需深入探索其生物学机制。MicroRNAs(MiRNAs)是一种由18~22个核苷酸组成的非编码RNA,在转录后抑制信使RNA的表达。近期研究表明,miR-581与胆管癌、结直肠癌和食管鳞癌的增殖及转移相关,也能够在胃癌的发展过程中发挥作用[4-7]。因此本研究拟探究miR-581在卵巢癌SKOV3细胞自噬中的作用及机制。
1 材料与方法
1.1 实验材料
人卵巢癌细胞系SKOV3购自BNCC(北纳生物,河南)公司。RPMI 1640培养基、胎牛血清、青霉素/链霉素双抗、0.25%胰酶均购自美国Gibco公司。miR-581 mimics、miR-581 NC以及miR-581引物和U6内参引物的设计及合成均由广州锐博生物科技有限公司完成。LC3抗体、Beclin1抗体、GAPDH抗体、FOXO1抗体均购自CST(美国)。miRNA提取试剂盒购自OMEGN公司(北京)。反转录试剂盒及实时荧光定量PCR试剂盒均购自广州锐博生物科技有限公司。蛋白裂解液、蛋白酶磷酸酶抑制剂混合物、SDS-PAGE凝胶配置试剂盒、BCA蛋白定量试剂盒购自上海碧云天生物技术有限公司。ECL发光液购自天根生化科技有限公司(北京)。质粒转染试剂盒Lip3000购自美国Thermo公司。FOXO1抑制剂AS1842856购自MCE公司(上海)。二氧化碳培养箱购自美国Heal-Force公司。ABI Step One Plus Real-Time PCR System购自美国应用生物系统公司。UVP BioSepctrum 610成像系统购自UVP美国紫外线制品有限公司。
1.2 实验方法
1.2.1 细胞培养
SKOV3细胞株在RPMI 1640完全培养基、37℃、5%CO2培养箱中培养,RPMI 1640完全培养基包含10%胎牛血清,1%双抗。培养基根据细胞生长状态进行更换,待细胞密度为70%~80%时,对细胞进行消化、传代和接种。
1.2.2 细胞分组
在检测miR-581过表达的SKOV3细胞构建时,观察miR-581对自噬相关蛋白LC3Ⅱ和Beclin1表达的影响和观察miR-581对靶基因FOXO1的影响,分别将细胞分为Control、miR-581 NC和miR-581 mimics组;在观察靶基因FOXO1对自噬相关蛋白LC3Ⅱ和Beclin1表达的影响时,将细胞分为Control和AS1842856组;在观察miR-581通过靶基因FOXO1对自噬相关蛋白LC3Ⅱ和Beclin1表达的影响时,将细胞分为Control、AS1842856、miR-581 mimics和miR-581 mimics+AS1842856组。上述分组,提取RNA时,转染组作用时间均为24 h;提取蛋白时,转染组作用时间均为48 h;AS1842856作用时间为24 h,且在miR-581 mimics+AS1842856组中AS1842856提前1 h加入。
1.2.3 细胞转染
将对数生长期的SKOV3细胞按照每毫升2.5×105个接种于6孔板中,待细胞密度为50%~60%时,根据Lip3000转染试剂说明书将miR-581 mimics及miR-581 NC转染进SKOV3细胞,放入细胞培养箱中继续培养至相应的时间。
1.2.4 实时荧光定量PCR检测miR-581表达量
将Control、miR-581 NC和miR-581 mimics三组细胞根据说明书分别提取miRNA,使用反转录试剂盒合成cDNA并作为模板进行实时荧光定量PCR(qRT-PCR)扩增,检测转染后miR-581的表达情况。所有反应均设3个复孔,SYBR Green嵌合荧光方法在荧光定量PCR仪上扩增目的基因和内参基因。以U6为内参基因,miR-581的相对定量用2-∆∆ct法。
1.2.5 Western blot检测相关蛋白表达水平
将Control、miR-581 NC、miR-581 mimics、AS1842856、miR-581 mimics+AS1842856五组细胞根据说明书提取细胞总蛋白,BCA蛋白浓度测试盒测定并将样品调定至统一浓度,加蛋白上样缓冲液,沸水煮10 min使蛋白变性,分装后于-80℃冰箱保存。取30 μg总蛋白通过聚丙烯酰胺凝胶电泳,电转移至NC膜,5%脱脂奶粉封闭1 h,分别加入用抗体稀释液稀释的特异性一抗LC3、Beclin1、FOXO1、GAPDH(1:1 000),4℃过夜。次日用TBST洗涤3次,每次10 min。放入稀释好的二抗中(1:2 000),室温孵育1 h,用TBST再次洗涤3次,每次10 min。ECL法显影,采用凝胶成像系统进行拍照,计算灰度值。以GAPDH为内参,观察各组检测蛋白的表达情况。
1.3 统计学方法
采用SPSS23.0软件进行统计学分析,实验数据为正态分布,采用均数±标准差表示。多组间比较采用单因素方差分析;两组间比较采用独立样本t检验。P < 0.05为差异有统计学意义。
2 结果
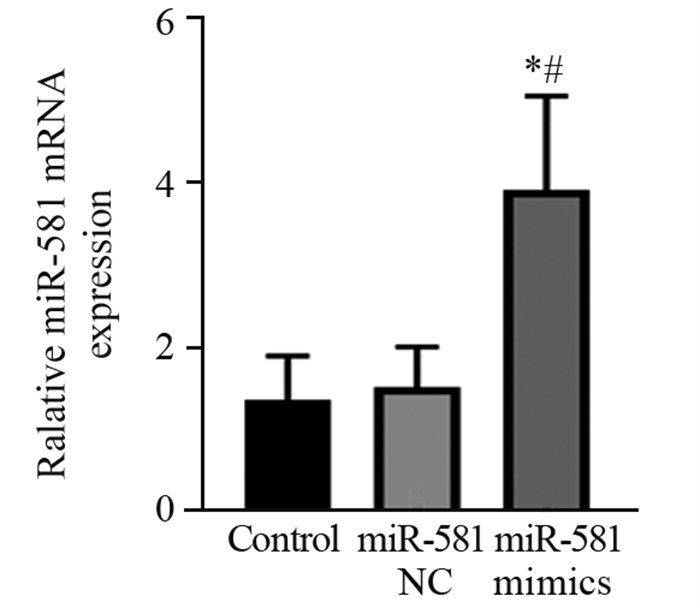
2.1 实时荧光定量PCR检测miR-581过表达的SKOV3细胞的构建
与Control组相比,miR-581 NC组miR-581的表达变化不明显(P > 0.05);miR-581 mimics组明显升高(P < 0.05);与miR-581 NC相比,miR-581 mimics组也明显升高(P < 0.05),以上结果表明miR-581过表达的SKOV3细胞的构建成功,见图 1。
2.2 过表达miR-581对卵巢癌SKOV3细胞自噬相关基因表达的影响
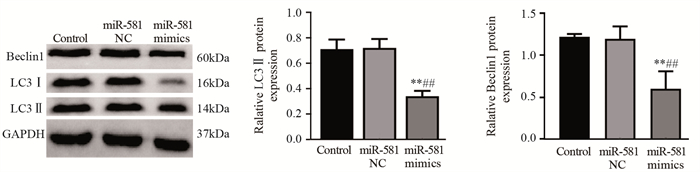
Western blot结果显示,与Control组相比,miR-581 NC组Beclin1、LC3Ⅱ表达量差异无统计学意义(均P > 0.05);与Control和miR-581 NC组相比,miR-581 mimics组Beclin1、LC3Ⅱ表达量均明显降低(均P < 0.01),表明过表达miR-581能够抑制卵巢癌SKOV3细胞自噬的发生,见图 2。
2.3 过表达miR-581对FOXO1蛋白表达的影响
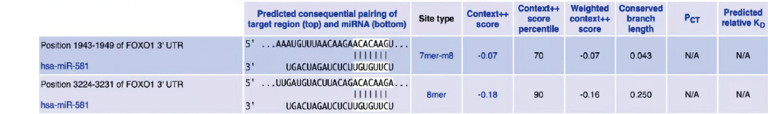
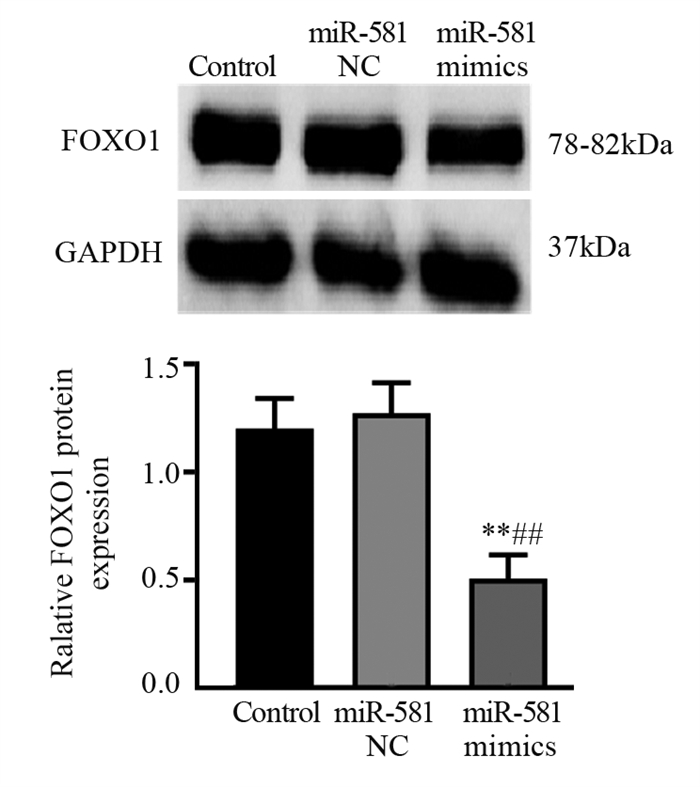
根据TargetScanHuman数据库预测显示FOXO1的3’UTR含有2处与miR-581互补的序列,见图 3,FOXO1可能为miR-581的靶基因。进一步Western blot验证结果显示,与Control组相比,miR-581 NC组FOXO1表达量无明显变化(P > 0.05);与Control和miR-581 NC组相比,miR-581 mimics组FOXO1表达量明显降低(均P < 0.01)。表明过表达miR-581能够抑制FOXO1的表达,见图 4。
2.4 FOXO1对卵巢癌SKOV3细胞自噬相关基因表达的影响
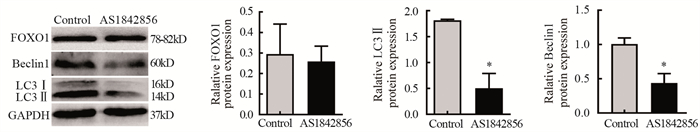
Western blot结果显示,与Control组相比,加入AS1842856后,LC3Ⅱ和Beclin1表达水平明显降低(P < 0.05),表明FOXO1能够促进卵巢癌SKOV3细胞自噬的发生,见图 5。
2.5 miR-581通过FoxO1影响卵巢癌细胞自噬
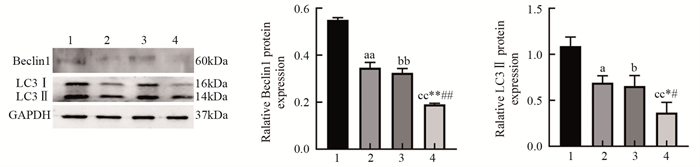
Western blot结果显示,与Control组相比,AS1842856组及miR-581 mimics组自噬相关蛋白LC3Ⅱ、Beclin1表达下调(P < 0.05、P < 0.01),miR-581 mimics+AS1842856组自噬相关蛋白LC3Ⅱ、Beclin1表达下调(P < 0.01、P < 0.01);与AS1842856组相比,miR-581mimics+AS1842856组自噬相关蛋白LC3Ⅱ、Beclin1表达下调(P < 0.05、P < 0.01);与miR-581mimics组相比,miR-581 mimics+AS1842856组自噬相关蛋白LC3Ⅱ、Beclin1表达下调(P < 0.05、P < 0.01),表明miR-581通过FOXO1影响卵巢癌细胞自噬,见图 6。
![]() 图 6 miR-581通过FOXO1影响卵巢癌细胞自噬1: Control; 2: AS1842856; 3: miR-581 mimics; 4: miR-581 mimics+AS1842856; a: P < 0.05, aa: P < 0.01, b: P < 0.05, bb: P < 0.01, cc: P < 0.01, compared with control group; *: P < 0.05, **: P < 0.01, compared with AS1842856 group; #: P < 0.05, ##: P < 0.01, compared with miR-581 mimics group.Figure 6 miR-581 affected autophagy of ovarian cancer cells through FOXO1
图 6 miR-581通过FOXO1影响卵巢癌细胞自噬1: Control; 2: AS1842856; 3: miR-581 mimics; 4: miR-581 mimics+AS1842856; a: P < 0.05, aa: P < 0.01, b: P < 0.05, bb: P < 0.01, cc: P < 0.01, compared with control group; *: P < 0.05, **: P < 0.01, compared with AS1842856 group; #: P < 0.05, ##: P < 0.01, compared with miR-581 mimics group.Figure 6 miR-581 affected autophagy of ovarian cancer cells through FOXO13 讨论
卵巢癌位于女性癌症性死亡的第五位,也是发达国家中最致命的妇科恶性肿瘤[8]。虽然卵巢癌的治疗手段有所提高,但在过去的20年里,卵巢癌患者的生存率并没有得到改善[9]。靶向治疗能影响肿瘤细胞、基质、血管或细胞信号转导通路[10],因此,靶基因的发现可能为卵巢癌的治疗提供新方向,进一步改善患者的生存率。
2006年首次证明miRNA与癌症的发生相关[11]。miRNA在癌症中的作用主要通过调控靶基因的表达来影响多种生物过程,包括增殖、分化、细胞周期、凋亡和免疫应答等[12]。近年来研究发现卵巢癌中差异表达的miRNA通过调控靶基因影响卵巢癌细胞自噬的发生[13]。
自噬是细胞内一种自我消化的过程,是维持细胞内稳态的重要途径,在细胞增殖、分化和衰老中发挥重要作用[14]。随着对自噬研究的深入了解,人们意识到自噬在肿瘤中的作用是一把双刃剑,它既可以促进也可以抑制肿瘤的发生,这取决于细胞环境和疾病阶段[15]。例如,在肿瘤发生的早期阶段,自噬水平的降低可促进癌细胞增殖,刺激自噬可能有益于癌症预防[16-17]。在近年来的研究中,多种类型的肿瘤细胞内均存在自噬水平的改变,如肺癌、乳腺癌、肝细胞癌等[14]。自噬在卵巢癌进展中的机制可能与自噬相关信号通路的激活或抑制、自噬相关的抑癌基因突变或缺失以及miRNAs的异常表达有关[3]。本实验结果表明,过表达miR-581抑制卵巢癌SKOV3细胞自噬。
有研究发现miR-581通过靶基因SMAD7、影响结直肠癌细胞转移[5]。miR-581在卵巢癌中的作用机制尚未阐明。FOXO1是叉头盒O(FOXO)家族成员,在肿瘤中具有重要的调控作用[18]。而最近研究发现FOXO1是不同细胞类型和疾病条件下调节自噬的关键介质[19]。如李云等[20]研究发现幽门螺杆菌VacA能够通过增加FOXO1蛋白的表达促进胃癌细胞的自噬。AS1842856是FOXO1的特异性抑制剂,有文献报道AS1842856仅通过与FOXO1结合而降低FOXO1活性,而不影响其转录和蛋白质表达[21]。本实验结果显示,加入抑制剂后,自噬相关蛋白表达减少,FOXO1表达变化不明显。TargetScanHuman数据库预测及Western blot结果显示,FOXO1为miR-581的靶基因,并且过表达的miR-581通过调控FOXO1的表达来影响卵巢癌细胞自噬。
综上,本实验在卵巢癌细胞水平上证明了过表达miR-581可抑制FOXO1的表达,进而抑制自噬的发生,为卵巢癌SKOV3细胞自噬的发展提供了新的理论机制,可能成为卵巢癌治疗的新靶点。
Competing interests:The authors declare that they have no competing interests作者贡献:高海宁:实验设计、实施及文章撰写白瑞霞、赵鹏伟:实验设计、评估及文章审校宋婉莹、林萱:部分实验操作 -
-
[1] Braga EA, Fridman MV, Moscovtsev AA, et al. LncRNAs in Ovarian Cancer Progression, Metastasis, and Main Pathways: ceRNA and Alternative Mechanisms[J]. Int J Mol Sci, 2020, 21(22): 8855. doi: 10.3390/ijms21228855
[2] 臧玉琴, 李慧慧, 王颖梅, 等. 自噬与子宫内膜癌关系的研究进展[J]. 中华妇产科杂志, 2021, 56(8): 584-587. doi: 10.3760/cma.j.cn112141-20210307-00118 [Zang YQ, Li HH, Wang YM, et al. Research progress on the relationship between autophagy and endometrial cancer[J]. Zhonghua Fu Chan Ke Za Zhi, 2021, 56(8): 584-587. ] doi: 10.3760/cma.j.cn112141-20210307-00118
[3] Zhan L, Zhang Y, Wang W, et al. Autophagy as an emerging therapy target for ovarian carcinoma[J]. Oncotarget, 2016, 7(50): 83476-83487.
[4] Xu Y, Kang P, Leng K, et al. Circ_ASPH promotes cholangiocarcinoma growth and metastasis through the miR-581/ATP-binding cassette transporter G1 signaling pathway[J]. Cancer Commun (Lond), 2020, 40(10): 545-550.
[5] Zhao X, Liu S, Yan B, et al. MiR-581/SMAD7 Axis Contributes to Colorectal Cancer Metastasis: A Bioinformatic and Experimental Validation-Based Study[J]. Int J Mol Sci, 2020, 21(18): 6499. doi: 10.3390/ijms21186499
[6] 程晔, 胡巧珍, 陈淑勤, 等. miR-581在食管鳞癌中的表达及其对食管鳞癌K30细胞增殖、迁移与侵袭的影响[J]. 福建医科大学学报, 2020, 54(4): 209-212. doi: 10.3969/j.issn.1672-4194.2020.04.001 [Cheng Y, Hu QZ, Cheng SQ, et al. Expression of miR-581 in Esophageal Squamous Cell Carcinoma (ESCC) Tissues and its Effect on Proliferation, Migration and Invasion of ESCC K30 Cells[J]. Fujian Yi Ke Da Xue Xue Bao, 2020, 54(4): 209-212. ] doi: 10.3969/j.issn.1672-4194.2020.04.001
[7] Nabatchian F, Naiini MR, Moradi A, et al. miR-581-Related Single Nucleotide Polymorphism, rs2641726, Located in MUC4 Gene, is Associated with Gastric Cancer Incidence[J]. Indian J Clin Biochem, 2019, 34(3): 347-351. doi: 10.1007/s12291-018-0751-0
[8] Lokman NA, Ho R, Gunasegaran K, et al. Anti-tumour effects of all-trans retinoid acid on serous ovarian cancer[J]. J Exp Clin Cancer Res, 2019, 38(1): 10. doi: 10.1186/s13046-018-1017-7
[9] Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7-30. doi: 10.3322/caac.21387
[10] 姜向阳, 李兴珍, 刘文康, 等. 高通量测序平台对卵巢癌基因突变的检测及意义[J]. 陕西医学杂志, 2017, 46(10): 1346-1348. doi: 10.3969/j.issn.1000-7377.2017.10.009 [Jiang XY, Li XZ, Liu WK, et al. Genetic mutation analysis of human ovarian cancer using next-generation sequencing platform[J]. Shaanxi Yi Xue Za Zhi, 2017, 46(10): 1346-1348. ] doi: 10.3969/j.issn.1000-7377.2017.10.009
[11] Zhang Z, Wang J, He J, et al. Genetic variants in MUC4 gene are associated with lung cancer risk in a Chinese population[J]. PLoS One, 2013, 8(10): e77723. doi: 10.1371/journal.pone.0077723
[12] Nguyen VHL, Yue C, Du KY, et al. The Role of microRNAs in Epithelial Ovarian Cancer Metastasis[J]. Int J Mol Sci, 2020, 21(19): 7093. doi: 10.3390/ijms21197093
[13] 彭志霞, 贾佳, 于东坡, 等. miR-30a对卵巢癌细胞PTEN/PI3K/AKT/mTOR自噬通路及顺铂耐药性的影响[J]. 现代肿瘤医学, 2021, 29(18): 3143-3148. doi: 10.3969/j.issn.1672-4992.2021.18.003 [Peng ZX, Jia J, Yu DP, et al. Effects of miR-30a on PTEN/PI3 K/AKT/mTOR autophagy pathway and cisplatin resist-ance of ovarian cancer cells[J]. Xian Dai Zhong Liu Yi Xue, 2021, 29(18): 3143-3148. ] doi: 10.3969/j.issn.1672-4992.2021.18.003
[14] 蒋琦炜, 张德宇, 石烟祝, 等. 细胞自噬与肿瘤发生发展[J]. 军事医学, 2021, 45(3): 314-320. https://www.cnki.com.cn/Article/CJFDTOTAL-JSYX202103016.htm [Jiang QW, Zhang DY, Shi YZ, et al. Autophagy and tumor development and progression[J]. Jun Shi Yi Xue, 2021, 45(3): 314-320. ] https://www.cnki.com.cn/Article/CJFDTOTAL-JSYX202103016.htm
[15] Das CK, Mandal M, Kögel D. Pro-survival autophagy and cancer cell resistance to therapy[J]. Cancer Metastasis Rev, 2018, 37(4): 749-766. doi: 10.1007/s10555-018-9727-z
[16] Mathew R, Karp CM, Beaudoin B, et al. Autophagy suppresses tumorigenesis through elimination of p62[J]. Cell, 2009, 137(6): 1062-1075. doi: 10.1016/j.cell.2009.03.048
[17] Chen HY, White E. Role of autophagy in cancer prevention[J]. Cancer Prev Res (Phila), 2011, 4(7): 973-983. doi: 10.1158/1940-6207.CAPR-10-0387
[18] 董书琴, 卢宇, 高菲, 等. FoxO1在糖脂代谢机制中的研究进展[J]. 大连医科大学学报, 2021, 43(5): 445-450. https://www.cnki.com.cn/Article/CJFDTOTAL-DLYK202105016.htm [Dong SQ, Lu Y, Gao F, et al. Research progress of FoxO1 in the mechanism of glucose and lipid metabolism[J]. Dalian Yi Ke Da Xue Xue Bao, 2021, 43(5): 445-450. ] https://www.cnki.com.cn/Article/CJFDTOTAL-DLYK202105016.htm
[19] Zhang L, Zhang Z, Li C, et al. S100A11 Promotes Liver Steatosis via FOXO1-Mediated Autophagy and Lipogenesis[J]. Cell Mol Gastroenterol Hepatol, 2021, 11(3): 697-724. doi: 10.1016/j.jcmgh.2020.10.006
[20] 李云, 罗娟. 幽门螺杆菌VacA通过SIRT1/FOXO1信号轴促进胃癌细胞的自噬[J]. 云南师范大学学报(自然科学版), 2021, 41(4): 74-78. https://www.cnki.com.cn/Article/CJFDTOTAL-YNSK202104012.htm [Li Y, Luo J. VacA of H. pylori Promotes Autophagy through SIRT1/FOXO1 Signaling Axis in Gastric Cancer Cells[J]. Yunnan Shi Fan Da Xue Xue Bao (Zi Ran Ke Xue Ban), 2021, 41(4): 74-78. ] https://www.cnki.com.cn/Article/CJFDTOTAL-YNSK202104012.htm
[21] He J, Zhang A, Song Z, et al. The resistant effect of SIRT1 in oxidative stress-induced senescence of rat nucleus pulposus cell is regulated by Akt-FoxO1 pathway[J]. Biosci Rep, 2019, 39(5): BSR20190112. doi: 10.1042/BSR20190112
-
期刊类型引用(3)
1. 张莉莉,甄飞. 组织内TRIM3及FoxO1表达与原发性肝癌患者病理特征及预后间的关系分析. 肝脏. 2024(01): 95-98 .  百度学术
百度学术
2. 刘丽利,丁桂春,陆红梅,王奕芳. 卵巢癌组织中miR-581、FOXO1表达与患者病理特征和预后的关系. 山东医药. 2023(22): 5-8 .  百度学术
百度学术
3. 唐剑峰,张涛,吴磊,曾佳欣. 辣椒素对前列腺癌细胞增殖及自噬的影响研究. 今日药学. 2022(10): 739-742 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: