Expression and Clinical Significance of Serum PTX3 in Hepatocellular Carcinoma
-
摘要:目的
探讨血清PTX3在肝细胞癌患者中的表达及临床意义。
方法选择78例肝癌患者作为肝癌组,同时选择健康体检者78例作为健康对照组,检测并比较两组PTX3水平差异,分析不同病理特征患者PTX3水平差异,并采用ROC曲线分析血清PTX3对肝癌的辅助诊断价值。
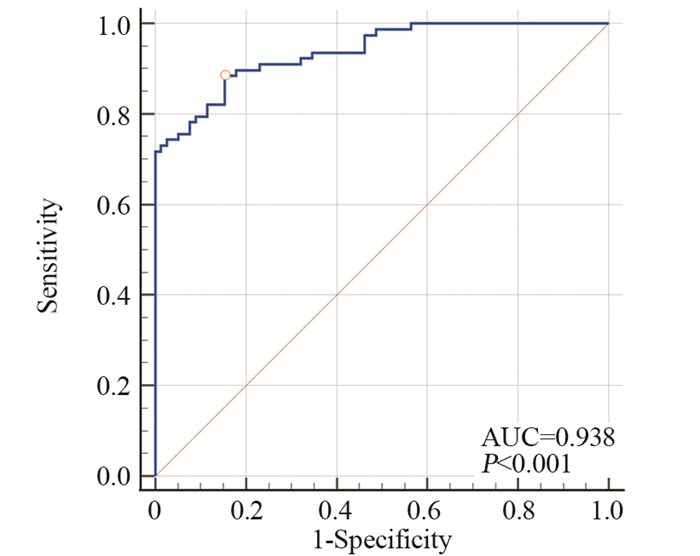
结果肝癌组患者血清中PTX3水平高于健康对照组(P < 0.05)。肝癌患者Ⅰ期组血清PTX3水平高于Ⅱ期组及Ⅲ期组(P < 0.05)。肿瘤直径≥5 cm患者血清中PTX3水平明显低于肿瘤直径 < 5 cm患者(P < 0.05);此外,合并HBV感染的肝癌患者血清中PTX3水平高于无HBV感染的患者(P < 0.05)。血清PTX3水平肝癌诊断的ROC曲线下面积为0.938。
结论肝癌患者血清PTX3表达水平显著升高,对肝癌有一定辅助诊断价值。
Abstract:ObjectiveTo investigate the expression and clinical significance of serum PTX3 in HCC patients.
MethodsWe selected 78 HCC patients as the liver cancer group, and 78 cases of healthy subjects as the healthy control group. The PTX3 levels were detected and compared between the two groups. The differences of PTX3 levels in patients with different pathological characteristics were analyzed. ROC curve was used to analyze the auxiliary diagnostic value of serum PTX3 in HCC.
ResultsPTX3 level in HCC patients was higher than that in healthy control group (P < 0.05). PTX3 level in stage Ⅰ group was higher than those in the stage Ⅱ group and Ⅲ group (P < 0.05). PTX3 level in patients with tumor ≥5cm was significantly lower than that with tumor diameter < 5cm (P < 0.05). In addition, PTX3 level in patients with HBV infection was significantly higher than that without HBV infection (P < 0.05). The AUC was 0.938.
ConclusionThe serum PTX3 level is significantly increased in patients with HCC. It has auxiliary diagnostic value for HCC.
-
Key words:
- Pentrin-3 /
- Hepatocellular carcinoma /
- Clinical diagnosis value
-
0 引言
中国胃癌患者平均死亡率高达20/10万,占恶性肿瘤的第一位[1]。究其原因可能与原发肿瘤致病基因突变、药物的敏感度反应、耐药机制多样性等异质性相关[2],为此,探求早期预测生物学进展标志物成为研究热点。本研究应用ELISA法、多重RNA/DNA原位分析等方法,对ⅢB期胃癌术后患者辅助化疗后随访期内进行动态检测外周血癌胚抗原(carcino-embryonic antigen, CEA)、p21活化激酶5(p21-activated kinase 5, PAK5)、循环肿瘤细胞(circulating tumor cells, CTC)以及同时期CT检查,以期达到早期生物学预测复发转移的目的。
1 资料与方法
1.1 临床资料
收集2015年1月—2017年12月河北医科大学第四医院肿瘤内科胃癌根治术后完全缓解的患者150例。入组条件:术前晨空腹肘部外周静脉血CEA值超过正常值的5倍、术后病理诊断为胃腺癌ⅢB期(T4bN1-2M0、T4aN2M0、T3N3M0)(按照AJCC第七版)。治疗方案以奥沙利铂或紫杉醇为主的方案辅助化疗6周期,其中多西他赛为主方案72例,奥沙利铂为主方案78例。后续定期随访,每3月进行CEA检测和影像学评估。
分组标准:随访期内血浆CEA检测正常患者设为对照组,共50例。随访期内第一次CEA升高超过正常值5倍患者为实验组,共100例,同时按CEA水平增高不同情况,再分为两组:CEA进行性增高组(实验A组)和无规律增高组(实验B组)。
入组患者基线情况:入组时患者整体分期、化疗周期数、血浆癌胚抗原CEA、PAK5、CTC和影像学检查肿瘤病情评估差异均无统计学意义(P > 0.05)。所有患者按照住院或门诊评估的方式进行随访,随访截至2017年12月31日。
1.2 检测方法和频次
应用ELISA、多重RNA/DNA原位分析等方法,分别采集两组患者不同时刻的晨空腹肘部外周静脉血,检测血浆中癌胚抗原CEA、PAK5和CTC的水平。CEA由我院生化室完成检测。PAK5和CTC均由广州益善公司协助完成检测。
动态检测时间点的选择:T0:术前癌胚抗原超过正常值5倍; T1:术后辅助化疗6周期后; T2:CEA首次超过正常值5倍,本研究将其确定为生物学进展时间; T3:首次CT证实进展和(或)无影像学进展的患者随访截止时间。实验组动态检测三次(T1、T2、T3),对照组动态检测两次(T1、T3)。
1.3 各指标阳性判定标准
癌胚抗原CEA阳性标准:CEA的正常值为 < 5 ng/ml。超过正常值的5倍为生物学进展阳性。CTC阳性标准:CTC检测分为上皮型、混合型、间质型,其中上皮型认定为良性,混合型认定为生物学进展,间质型认定为恶性复发转移,即为影像学进展,见图 1。PAK5检测标准:根据表达强度分为无表达、低表达、中表达、高表达。本研究判定标准:无表达和低表达为阴性,中表达和高表达为阳性,其中中表达/总细胞数的比率判定为生物学进展; 高表达/总细胞数的比率判定为影像进展,见图 2。
2 结果
2.1 CEA与胃癌术后疾病进展关系
截至随访时间,对照组50例患者中均未见CEA增高,影像学未见明确病灶。实验两组中,按照生物学进展时间(T2):实验A组为3~24月,中位时间13月。实验B组为4~32月,中位时间22月。按照影像进展时间(T3):实验A组39例(78%)进展,出现时间为5~8月,中位时间为6.2月。实验B组12例(24%)进展,出现时间为4~15月,中位时间为10.6月。实验A组较B组更能提示复发转移。
2.2 CTC变化情况与胃癌术后疾病进展关系
T2时,实验A组混合型和间质型之和/总单细胞数比值大于30%,提示生物学进展; 间质型细胞数≥1在两实验组之间有差异,但无统计学意义。T3时,实验A组混合型和间质型之和/总单细胞数比值大于50%,提示影像学进展。间质型细胞数≥1在两实验组之间有差异,但病例数尚少,未行统计学分析,见表 1。
表 1 实验组CTC变化与ⅢB期胃癌术后患者肿瘤进展的关系Table 1 Relation between CTC change and tumor progression in patients with stage ⅢB gastric cancer after operation
2.3 PAK5变化与胃癌术后疾病进展关系
T2时,无表达、低表达、中表达数据没有偏移,两组间高表达数据有偏移; T3无表达、低表达数据没有偏移,两组间中、高表达数据有偏移。因为病例数尚少,未行统计学分析,见表 2。
表 2 PAK5表达与ⅢB期胃癌术后患者复发进展的关系Table 2 Relation between PAK5 expression and tumor progression in patients with stage ⅢB gastric cancer after operation
对明确影像学进展的51例患者的CTC细胞进行PAK5检测,中表达数值为13.6%~83%,高表达数值为37.8%~100%。
2.4 实验组CEA、PAK5、CTC三者阳性表达一致性
由于实验B组仅有12例(24%)患者影像学提示进展,病例数尚少,未行统计学分析。对实验A组39例影像学提示进展患者进行比较,T2时,CTC和PAK5、CEA判定的一致性为82%。T3时,和PAK5、CEA判定的一致性为94%。
3 讨论
中国ⅢB期胃癌术后5年生存率仅为15%~35%,究其原因在于部分患者术后即发生早期转移。临床上常常将癌胚抗原(CEA)作为ⅢB期胃癌术后随访复发转移的生物标志物[3]。本研究CEA进行性增高组(实验A组)有78%的患者肿瘤影像证实进展,有利于早期诊断复发转移。而CEA无规律增高组(实验B组)仅有24%提示肿瘤影像学进展,单指标检测存在假阳性,与文献报道CEA具有非特异性、易受炎性反应性疾病的干扰相一致。因此,提高预测指标的准确性成为临床研究的趋势,才能更好地避免给患者带来精神压力和过度治疗的可能性。
有研究报道CTC的间质型细胞具有恶性行为[4-6],但对于混合型的恶性度报道不一,实体瘤的异质性导致的胃癌CTC的阳性标准不同于乳腺癌,尚无明确共识。本研究数据表明间质型细胞数大于1可早期预测影像学进展。但对于混合型的恶性度报道不一,本研究考虑混合型细胞具有恶性变的趋势,疾病进展演变成间质型,其演变过程是从肿瘤生物学进展发展到影像学进展的过程,可以很好地预测影像学进展。本研究应用统计学分析(混合型+间质型)/总单细胞数比值大于30%可早期预测生物学进展可能; (混合型+间质型)/总单细胞数比值大于50%可早期预测影像学进展可能。由于混合型细胞中有良性细胞成分和恶性成分,因本研究例数尚少,目前尚无更好的方法区分生物学进展,待扩大样本数后进一步进行验证。
为了更好的推算混合型向间质型细胞的演化时间,本研究增加检测了一种上游癌基因P21活化激酶亚型PAK5,有学者对恶性肿瘤组织标本检测数据表明PAK5过度表达或突变激活,参与了部分恶性实体瘤发生、发展[7-14],但在胃癌中的研究较少[15-16]。本研究数据表明PAK5参与了胃癌细胞生长增殖的调节。PAK5的无/中表达表明肿瘤细胞进入复制分裂期的增殖数目较少、恶性度低; PAK5的中/高表达表明肿瘤细胞进入增殖期数目多、恶性度高。本研究明确影像学进展的51例患者生物学进展时刻时PAK5的中表达数值为13.6%~83%,高表达数值为37.8%~100%。结果显示PAK5的中/高表达可预测生物学进展,实验数据范围较广,我们考虑PAK5检测的敏感度和特异性可能会导致假阳性/假阴性。但因为例数较少,未行统计学分析。
本研究数据单因素检测存在误差,对癌培抗原进行性增高组影像学进展确定进展的39例患者进行CEA、PAK5、CTC三者联合检测的一致性上,预测生物学进展的一致率为82%;预测肿瘤影像学进展的一致率为94%,联合检测可提高预测率,降低检测误差。
因此,联合动态检测CEA、PAK5、CTC预测ⅢB期胃癌术后生物学进展,更早于影像进展诊断,可降低单一指标的假阳/阴性率,提高检出阳性率,防止漏诊、误诊的发生。
Competing interests: The authors declare that they have no competing interests.作者贡献:庞康清:研究设计、实施、数据收集分析、论文撰写及修改马洪德:数据收集整理杨汝磊:数据收集分析庞国宏:研究设计指导、文章写作指导及校对 -
表 1 两组一般资料比较
Table 1 Comparison of basic characteristics between two groups

表 2 不同分期肝癌患者血清PTX3表达水平比较(x±s)
Table 2 Comparison of serum PTX3 expression levels in patients with different stages of hepatocellular carcinoma (x±s)

表 3 血清PTX3水平与患者病理特征的关系(x±s)
Table 3 Relation between serum PTX3 level and pathological characteristics of patients with hepatocellular carcinoma (x±s)

-
[1] Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[2] Parikh ND, Mehta AS, Singal AG, et al. Biomarkers for the Early Detection of Hepatocellular Carcinoma[J]. Cancer Epidemiol Biomarkers Prev, 2020, 29(12): 2495-2503. doi: 10.1158/1055-9965.EPI-20-0005
[3] 曹丽荣. 肿瘤标志物联合甲胎蛋白检测方法在原发性肝癌患者中的诊断研究[J]. 中国药物与临床, 2017, 17(6): 909-911. Chao LR. Study on the diagnosis of primary liver cancer patients with tumor markers combined with alpha-fetoprotein detection[J]. Zhongguo Yao Wu Yu Lin Chuang, 2017, 17(6): 909-911.
[4] 陈利君, 陈静琦, 曾波航. 肝癌组织中CD68+肿瘤相关巨噬细胞数量与Ki-67蛋白表达及原发性肝癌预后的关系[J]. 肿瘤防治研究, 2016, 43(9): 774-778. doi: 10.3971/j.issn.1000-8578.2016.09.009 Chen LJ, Chen JQ, Zeng BH, et al. Correlation of CD68+ Tumor-associated Macrophages Number with Ki-67 Expression and Prognosis of Patients with Primary Hepatocellular Carcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(9): 774-778. doi: 10.3971/j.issn.1000-8578.2016.09.009
[5] Inforzato A, Doni A, Barajon I, et al. PTX3 as a paradigm for the interaction of pentraxins with the complement system[J]. Semin Immunol, 2013, 25(1): 79-85. doi: 10.1016/j.smim.2013.05.002
[6] Rubino M, Kunderfranco P, Basso G, et al. Epigenetic regulation of the extrinsic oncosuppressor PTX3 gene in inflammation and cancer[J]. Oncoimmunology, 2017, 6(7): e1333215.
[7] Doni A, Stravalaci M, Inforzato A, et al. The Long Pentraxin PTX3 as a Link Between Innate Immunity, Tissue Remodeling, and Cancer[J]. Front Immunol, 2019, 10: 712. doi: 10.3389/fimmu.2019.00712
[8] Daigo K, Inforzato A, Barajon I, et al. Pentraxins in the activation and regulation of innate immunity[J]. Immunol Rev, 2016, 274(1): 202-217. doi: 10.1111/imr.12476
[9] Liu B, Zhao Y, Guo L. Increased serum pentraxin-3 level predicts poor prognosis in patients with colorectal cancer after curative surgery, a cohort study[J]. Medicine (Baltimore), 2018, 97(40): e11780. doi: 10.1097/MD.0000000000011780
[10] Infante M, Allavena P, Garlanda C, et al. Prognostic and diagnostic potential of local and circulating levels of pentraxin 3 in lung cancer patients[J]. Int J Cancer, 2016, 138(4): 983-991. doi: 10.1002/ijc.29822
[11] Choi B, Lee EJ, Park YS, et al. Pentraxin-3 Silencing Suppresses Gastric Cancer-related Inflammation by Inhibiting Chemotactic Migration of Macrophages[J]. Anticancer Res, 2015, 35(5): 2663-2668.
[12] Song T, Wang C, Guo C, et al. Pentraxin 3 overexpression accelerated tumor metastasis and indicated poor prognosis in hepatocellular carcinoma via driving epithelial-mesenchymal transition[J]. J Cancer, 2018, 9(15): 2650-2658. doi: 10.7150/jca.25188
[13] 中华人民共和国卫生和计划生育委员会医政医管局. 原发性肝癌诊疗规范(2017年版)[J]. 中华消化外科杂志, 2017, 16(7): 635-647. Bureau of Medical Administration, Health and Family Planning Commission of the People's Republic of China. Standardization of diagnosis and treatment for hepatocellular carcinoma(2017 edition)[J]. Zhonghua Xiao Hua Wai Ke Za Zhi, 2017, 16(7): 635-647.
[14] 叶冬雪, 刘芬, 杨茜, 等. Mina53与CBX8在肝细胞肝癌中的表达及其与临床病理特征和预后的关系[J]. 肿瘤防治研究, 2020, 47(6): 451-456. doi: 10.3971/j.issn.1000-8578.2020.19.1341 Ye DX, Liu F, Yang Q, et al. Expression of Mina 53 and CBX8 in Hepatocellular Carcinoma and Their corelation with Clinicopathological Features and Prognosis[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(6): 451-456. doi: 10.3971/j.issn.1000-8578.2020.19.1341
[15] 赵荣荣, 邓永东, 袁宏. 236例原发性肝癌患者流行病学及临床特点分析[J]. 临床肝胆病杂志, 2016, 32(8): 1538-1542. doi: 10.3969/j.issn.1001-5256.2016.08.021 Zhao RR, Deng YD, Yuan H. Epidemiological and clinical features of primary liver cancer: an analysis of 236 patients[J]. Lin Chuang Gan Dan Bing Za Zhi, 2016, 32(8): 1538-1542. doi: 10.3969/j.issn.1001-5256.2016.08.021
[16] 程书平, 李明, 谭诗云. 血清AFP、PIVKA-Ⅱ、GGT、GGT/ALT检测对早期原发性肝癌的诊断价值[J]. 山东医药, 2021, 26(1): 61-65. doi: 10.3969/j.issn.1002-266X.2021.01.014 Cheng SP, Li M, Tan SY. The diagnostic value of serum AFP, PIVKA-Ⅱ, GGT, GGT/ALT for early primary liver cancer[J]. Shandong Yi Yao, 2021, 26(1): 61-65. doi: 10.3969/j.issn.1002-266X.2021.01.014
[17] 杨文聪, 魏统双. 血清miR-122-5p水平联合MSCT对肝癌的诊断价值[J]. 中国CT和MRI杂志, 2021, 19(4): 86-89. doi: 10.3969/j.issn.1672-5131.2021.04.027 Yang WC, Wei TS. Diagnostic value of serum miR-122-5p level combined with MSCT for liver cancer[J]. Zhongguo CT He MRI Za Zhi, 2021, 19(4): 86-89. doi: 10.3969/j.issn.1672-5131.2021.04.027
[18] 刘毓键, 马明洋. 血清标志物在肝细胞肝癌早期诊断中的研究进展及应用前景[J]. 医学综述, 2020, 26(7): 1325-1330, 1336. doi: 10.3969/j.issn.1006-2084.2020.07.016 Liu YJ, Ma MY. Research progress and application prospect of serum markers in early detection of hepatocellular carcinoma[J]. Yi Xue Zong Shu, 2020, 26(7): 1325-1330, 1336. doi: 10.3969/j.issn.1006-2084.2020.07.016
[19] 彭婉君, 赵彬彬, 武婧, 等. 可溶性识别分子PTX3的研究进展[J]. 中国比较医学杂志, 2020, 30(1): 115-121. doi: 10.3969/j.issn.1671-7856.2020.01.020 Peng WJ, Zhao BB, Wu J, et al. Research progress on soluble recognition molecule PTX3[J]. Zhongguo Bi Jiao Yi Xue Za Zhi, 2020, 30(1): 115-121. doi: 10.3969/j.issn.1671-7856.2020.01.020
[20] Deng H, Fan X, Wang X, et al. Serum pentraxin 3 as a biomarker of hepatocellular carcinoma in chronic hepatitis B virus infection[J]. Sci Rep, 2020, 10(1): 20276. doi: 10.1038/s41598-020-77332-3
[21] 代伟伟, 刘正新, 徐宝宏. 肝硬化和肝癌患者血清CA125、CA199、AFP和CEA水平变化[J]. 实用肝脏病杂志, 2017, 20(1): 81-84. doi: 10.3969/j.issn.1672-5069.2017.01.021 Dai WW, Liu ZX, Xu BH. Serum CA125, CA199, AFP, CEA in patients with cirrhosis and primary liver cancer[J]. Shi Yong Gan Zang Bing Za Zhi, 2017, 20(1): 81-84. doi: 10.3969/j.issn.1672-5069.2017.01.021
[22] Feder S, Haberl E M, Spirk M, et al. Pentraxin-3 is not related to disease severity in cirrhosis and hepatocellular carcinoma patients[J]. Clin Exp Med, 2020, 20(2): 289-297. doi: 10.1007/s10238-020-00617-4
[23] Bonavita E, Gentile S, Rubino M, et al. PTX3 Is an Extrinsic Oncosuppressor Regulating Complement-Dependent Inflammation in Cancer[J]. Cell, 2015, 160(4): 700-714. doi: 10.1016/j.cell.2015.01.004
-
期刊类型引用(2)
1. 李伟,韩晓峦,杨质彬,何阿仃,韩楠男,张春叶,阮敏,王元银. 原发性舌鳞癌MRI浸润深度与病理浸润深度的相关性研究. 中国肿瘤临床. 2024(19): 974-979 .  百度学术
百度学术
2. 安星妃,章礼玉,彭晖,王倩,翁海燕,周瑜. 淋巴结产量及淋巴结比率在cN0口腔鳞癌中的预后价值分析. 中国口腔颌面外科杂志. 2024(06): 563-571 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载: