Enhanced Effect of miR-148a Targeting STAT3 on Chemosensitivity of Cervical Cancer HeLa Cells to Cisplatin
-
摘要:目的
探究miR-148a对宫颈癌HeLa细胞顺铂化疗敏感度的影响及相关机制。
方法体外培养宫颈癌HeLa细胞,设置顺铂浓度梯度检测IC20值;设置对照组、mimic对照组、miR-148a mimic组、inhibitor对照组和miR-148a inhibitor组,转染后使用qRT-PCR法检测miR-148a和STAT3 mRNA表达;4 μmol/L顺铂处理后,MTT法检测细胞增殖,流式细胞仪检测细胞凋亡及细胞周期分布,Western blot法检测p-STAT3/STAT3、CyclinD1、Bcl-2、Bax、Cleaved caspase-3蛋白表达。
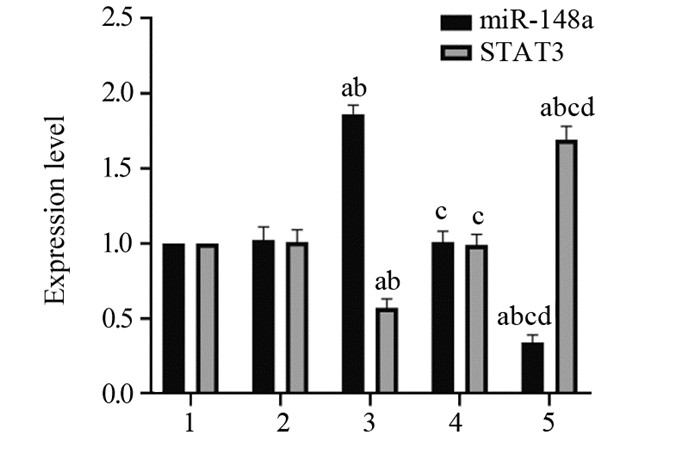
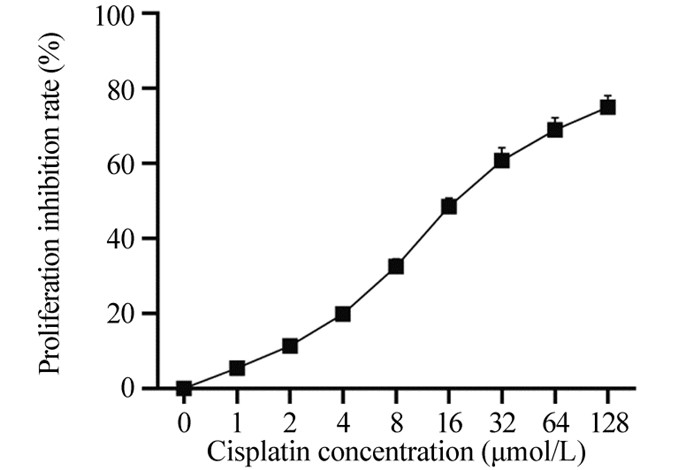
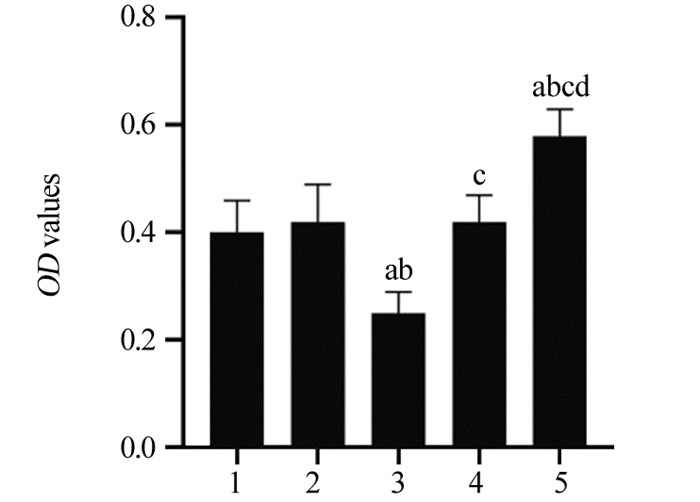
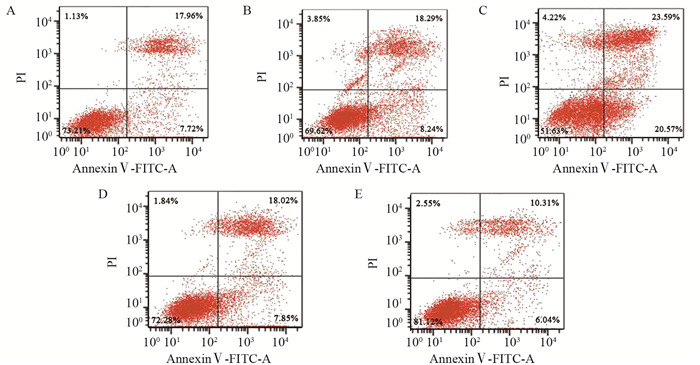
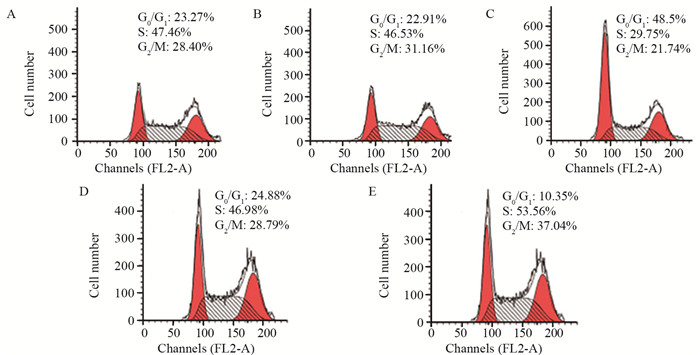
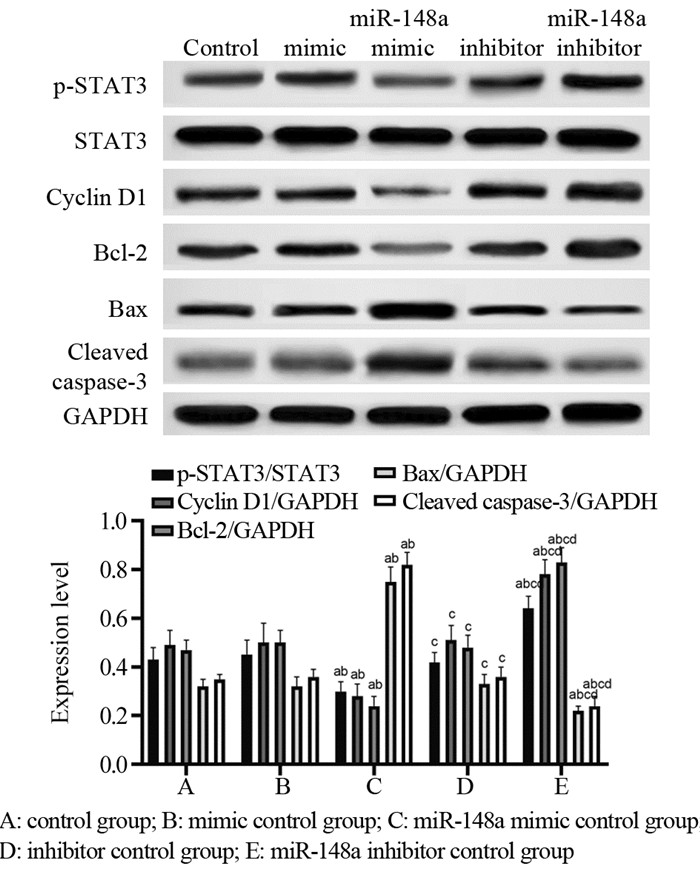
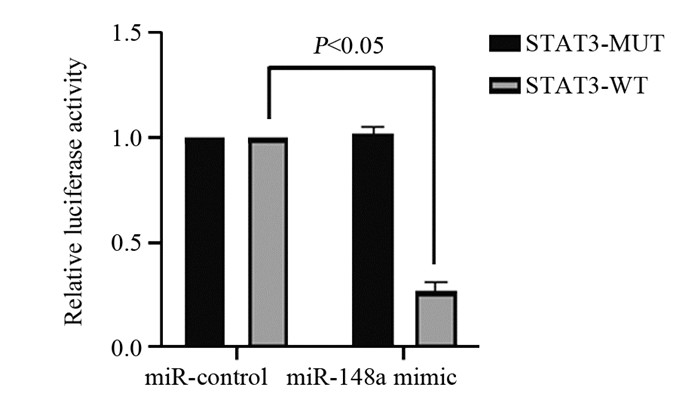
结果HeLa细胞的顺铂IC20约为4 μmol/L。与mimic对照组相比,miR-148a mimic组HeLa细胞中miR-148a水平显著升高,STAT3 mRNA水平显著降低(P < 0.05);与inhibitor对照组相比,miR-148a inhibitor组HeLa细胞中miR-148a水平显著降低,STAT3 mRNA水平显著升高(P < 0.05)。顺铂处理后,与mimic对照组相比,miR-148a mimic组HeLa细胞凋亡率、G0/G1期细胞比例、Bax、Cleaved caspase-3蛋白水平显著升高,OD值、S期和G2/M期细胞比例及p-STAT3/STAT3、Cyclin D1、Bcl-2蛋白水平显著降低(P < 0.05);与inhibitor对照组相比,miR-148a inhibitor组HeLa细胞上述指标均朝相反的趋势显著变化(P < 0.05)。
结论miR-148a可通过靶向抑制STAT3增强宫颈癌HeLa细胞的顺铂化疗敏感度。
-
关键词:
- 微小RNA-148a /
- 信号转导和转录激活因子3 /
- 宫颈癌HeLa细胞 /
- 顺铂 /
- 化疗敏感度
Abstract:ObjectiveTo investigate the effect of miR-148a on the chemosensitivity of cervical cancer HeLa cells to cisplatin and its related mechanism.
MethodsCervical cancer HeLa cells were cultured in vitro and the concentration gradient of cisplatin was set to detect IC20 value. Control group, mimic control group, miR-148a mimic group, inhibitor control group and miR-148a inhibitor group were set up. qRT-PCR was used to detect the expression of miR-148a and STAT3 mRNA after transfection. After 4 μmol/L cisplatin treatment, the proliferation of HeLa cells was detected by MTT assay; the apoptosis and cell cycle distribution were detected by flow cytometry; Western blot was used to detect the protein expression of p-STAT3/STAT3, CyclinD1, Bcl-2, Bax and Cleaved caspase-3.
ResultsThe IC20 of cisplatin on HeLa cells was about 4 μmol/L. Compared with the mimic control group, the level of miR-148a in the miR-148a mimic group was significantly increased, and the level of STAT3 mRNA was significantly decreased (P < 0.05). Compared with the inhibitor control group, the level of miR-148a in HeLa cells in miR-148a inhibitor group was significantly decreased, and the level of STAT3 mRNA was significantly increased (P < 0.05). On the basis of cisplatin treatment, compared with the mimic control group, the apoptosis rate, G0/G1 phase cell ratio, the protein levels of Bax and Cleaved caspase-3 were significantly increased in miR-148a mimic group, while OD value, the proportions of cells in S and G2/M phase, the protein levels of p-STAT3/STAT3, CyclinD1, Bcl-2 were significantly decreased (P < 0.05); compared with the inhibitor control group, the above indicators of HeLa cells in miR-148a inhibitor group changed significantly in the opposite direction (P < 0.05).
ConclusionMiR-148a could enhance the chemosensitivity of cervical cancer HeLa cells to cisplatin by targetedly inhibiting STAT3.
-
0 引言
胃癌是世界上癌症相关死亡的三大常见原因之一。目前根治性手术以及放化疗等辅助治疗方案的联合应用,胃癌患者的生存期已显著延长[1]。但是大多数患者最终会对化疗药物产生耐药现象,胃癌患者并不能通过传统的治疗方法受益,因此寻找新的治疗策略是当务之急[2]。有研究发现miR-451可促进消化道肿瘤的发生发展,然而,miR-451是否参与胃癌对5-Fu耐药的调节仍未可知[3]。MRP通过细胞外和细胞内膜运输各种分子,涉及多重耐药性[4]。该蛋白质作为多特异性有机阴离子转运蛋白起作用,是广泛表达于人体各组织中的耐药基因,在调节肿瘤对药物的反应性过程中发挥重要作用。在非小细胞肺癌中,MRP可作为耐药基因影响患者对铂类药物的敏感度[5]。本研究拟通过RT-PCR检测miR-451在胃癌中的表达水平,在细胞水平上分析其对胃癌细胞增殖、迁移能力的影响,并揭示其可能参与的分子调控路径。
1 资料与方法
1.1 资料
293T细胞、胃癌亲本细胞株(BGC-823、SGC-790、MKN-4、MKN-45、MKN-28)及BGC-823耐药细胞株、MKN-4耐药细胞株、MKN-28耐药细胞株均购自ATCC(美国);DMEM细胞培养基购自SIGMA-ALDRICH公司(德国);胎牛血清购自Gibco公司(美国);CCK8试剂盒购自MCE公司(中国);psPAX2、pMD2G、pLenti-miR-451 or pLenti-control均购自优宝生物(中国);miRNA-451引物、U6引物、GAPDH引物、MRP引物、NC inhibitor以及miR-451 inhibitor购自广州锐博生物科技有限公司(中国);RNA提取试剂盒购自TaKaRa公司(日本);RNA反转录试剂盒(Revert Aid First Strand cDNA Synthesis Kit)以及miRNA Universal SYBR® qPCR Master Mix试剂盒购自南京诺唯赞生物科技有限公司(中国);一抗GAPDH及辣根过氧化物酶标记的羊抗兔/鼠二抗均购于三鹰生物科技有限公司(中国);Western blot试剂盒及BCA蛋白浓度测量试剂盒购自碧云天生物技术公司(中国)。
1.2 组织来源
收集西安医学院第一附属医院胃癌患者20例,取癌组织和癌旁组织样本后立即置于-80℃液氮中冷冻待用。
1.3 细胞培养
293T细胞、胃癌细胞系(BGC-823、SGC-790、MKN-4、MKN-45和MKN-28)培养于含10%FBS的DMEM中,BGC-823耐药细胞株、MKN-4耐药细胞株、MKN-28耐药细胞株培养于含1 mg/L的10%FBS的DMEM中,且均在含饱和湿度、5%CO2、37℃的细胞培养箱中培养。
1.4 病毒包装
胰酶消化收集对数期生长的293T细胞,待细胞生长至60%时,按照病毒包装以及转染试剂要求,pLenti-control/pLenti-miR-451:psPAX2: pMD2G=4:3:1混合后,转染入293T细胞,6 h后更换新鲜DMEM培养基,48 h收集细胞上清液用于转染胃癌细胞(MKN-4/MKN-28/BGC-823耐药细胞株)。
1.5 构建稳定过表达细胞系
胰酶消化生长于对数期的胃癌细胞系(MKN-4/MKN-28/BGC-823耐药细胞株),待细胞生长至50%时,按要求转染胃癌细胞,24 h后更换新鲜培养基,持续使用嘌呤霉素(1 mg/L)筛选,2周后,荧光定量PCR检测过表达效率。
1.6 细胞转染
取对数生长期的细胞,以105个/孔密度接种于6孔板中,待细胞融合度达到80%时,采用LipofectamineTM 3000将miR-451 inhibitor转染入胃癌细胞系(MKN-4、MKN-28耐药细胞株),继续培养4 h后,更换含FBS的DMEM培养基继续培养以供后续实验。
1.7 RNA提取及荧光定量
从不同胃癌组织及胃癌细胞系(BGC-823、SGC-790、MKN-4、MKN-45、MKN-28)中提取RNA用于测定胞内miR-451的相对表达量。按照RNA提取试剂盒要求提取RNA,按照反转录试剂盒要求将其反转录为CDNA,合成的CDNA按照miRNA Universal SYBR®qPCR Master Mix试剂盒要求进行PCR扩增,以U6为内参检测miR-451的表达,以GAPDH为内参检测MRP的表达。U6正向引物序列:5’-GCTTGCTTCAGCAGCACATA-3’,反向引物:5’-AAAAACATGGAACTCTTCACG-3’;miR-45正向引物:5’-CCGAAACCGTTACCATTAC-3’,反向引物:5’-GTGCAGGGTCCGAGGT-3’;GADPH正向引物:5’-GGCATGGACTGTGGTCATGAG-3’,反向引物:5’-TGCACCACCAACTGTTAGC-3’;MRP正向引物:5’-CCCGCTCTGGGACTGGAA-3’,反向引物:5’-ACTTGTTCCGACGTGTCCTC-3’。以上实验均重复三次。
1.8 Western blot检测MRP的表达
取处理好的细胞,加入RIPA裂解液后冰浴30 min使细胞充分裂解,120 000 r/min 4℃,离心10 min,取上清液,蛋白定量,SDS-PAGE电泳2 h,NC膜转膜2.5 h,室温用含5%脱脂奶粉的TBST封闭1 h,一抗MRP以1:2 000配制,β-actin以1:5 000配制,室温孵育4 h,TBST溶液洗3次,每次10 min,二抗以1:5 000稀释配制,室温孵育1 h,TBST溶液洗3次,每次10 min,曝光显影。
1.9 荧光素酶实验
将稳定过表达miR-451的BGC-823、MKN-4耐药细胞株以及对照细胞株接种于24孔板(1.0×105个/孔)。24 h后,将pGL3-MRP-3’野生型以及突变型质粒转染稳定过表达的上述细胞,海参荧光素酶作为内参,24 h后检测荧光素酶活性差异。
1.10 CCK8检测细胞活力
取稳定过表达miR-451的BGC-823、MKN-4耐药细胞株,接种于96孔板(2×103个/孔)中,每组设4个平行复孔。分别加入0、2、4、6、8、10 g/ml 5-Fu,48 h后避光加入20 μl CCK-8溶液,常规孵育2.5 h后,多功能酶标仪检测450 nm波长处的吸光度(A)值,计算细胞增殖能力。
1.11 统计学方法
应用SPSS16.0软件进行统计分析,相关性分析符合Pearson相关性分析方法,计量数据用均数±标准差(x±s)表示,组间比较采用t检验,每组实验至少重复3次,P < 0.05为差异有统计学意义。
2 结果
2.1 miR-451在不同胃癌组织及胃癌细胞系中的表达
RT-PCR检测结果显示耐药胃癌组织中miR-451表达量明显低于非耐药胃癌组织(P=0.00043)。胃癌细胞株MKN-4 miR-451相对表达量为9.26±1.02,MKN-28细胞系中miR-451相对表达量为63.42±6.84,见图 1。
2.2 miR-451过表达抑制胃癌细胞增殖且降低胃癌细胞对5-Fu的耐药性
构建miR-451稳定过表达MKN-4耐药细胞株,结果显示miR-451显著过表达。miR-451 inhibitor转染MKN-28耐药细胞株,结果显示miR-451表达明显受到抑制,见图 2A。在不同5-Fu浓度刺激下,过表达miR-451可明显降低耐药细胞的增殖能力,抑制miR-451表达可促进耐药细胞系的增殖能力,见图 2B。
2.3 MiR-451对MRP表达的调节作用
miRBase、TargetScan、miRanda、miRDB生物数据库分析结果显示MRP为miR-451的靶基因,见图 3A。随之,构建MRP野生型以及突变型荧光报告质粒,见图 3B。荧光素酶报告实验证明,在转染野生型的双荧光报告质粒后,miR-451过表达使荧光素酶相对活性明显降低(P < 0.01),而突变型则无限制变化,见图 3C~D。以上结果证明miR-451靶向MRP的3’UTR。
![]() 图 3 miR-451的靶基因分析Figure 3 Analysis of miR-451 target geneA: Bioinformatics analysis results showed that MRP was the target gene of miR-451; B: We constructed 3'UTR wild-and mutant-type dual fluorescein reporter plasmids of MRP; C, D: miR-451 regulated the fluorescence activity of wild-type and mutant MRP reporter plasmids in BGC-823 and MKN-4 cells
图 3 miR-451的靶基因分析Figure 3 Analysis of miR-451 target geneA: Bioinformatics analysis results showed that MRP was the target gene of miR-451; B: We constructed 3'UTR wild-and mutant-type dual fluorescein reporter plasmids of MRP; C, D: miR-451 regulated the fluorescence activity of wild-type and mutant MRP reporter plasmids in BGC-823 and MKN-4 cells2.4 miR-451调控MRP的表达
miR-451过表达可明显抑制MRP转录(P=0.00075),见图 4A。20例胃癌组织中miR-451以及MRP mRNA水平显著负相关,见图 4B。Western blot检测结果显示过表达miR-451可显著降低MRP蛋白水平(P=0.000045),而miR-451 inhibitor抑制miR-451表达后,其蛋白水平出现明显上调(P=0.00029),见图 4C。
2.5 过表达MRP可促进耐药细胞系对5-Fu的耐药性
在稳定过表达miR-451的耐药细胞系BGC-283以及MKN-4中过表达MRP,Western blot实验证明了MRP的过表达效率(P=0.000062)。相对单一过表达miR-451的胃癌细胞系,miR-451可明显增加胃癌耐药细胞系BGC-283以及MKN-4对5-Fu的敏感度,其细胞增殖能力明显低于对照组;而CCK8检测结果显示,相对于单一过表达miR-451,过表达miR-451和MRP可明显增加细胞的增殖能力(P=0.00032),见图 5。说明MRP可增加胃癌细胞对5-Fu的耐受能力。
3 讨论
药物抵抗是目前胃肠道肿瘤治疗的一大难题,现有的胃肠道肿瘤治疗方案难以进一步提高患者的生存期,开发新的药物靶点是肿瘤治疗的当务之急[6]。MicroRNA作为非编码RNA参与肿瘤细胞的增殖、分化以及凋亡,有文献证明了microRNA作为治疗靶点用于肿瘤等疾病的可行性[7]。Tsuchiya等[8]发现miR-451有助于上皮细胞基底外侧极性的形成。Ribeiro-dos-Santos等[9]通过高通量测序建立了人胃组织miRNA表达谱,结果发现miR-31、miR-9b、miR-148a以及miR-451在胃癌组织中高度表达,说明miR-451可作为药物治疗的靶点用于胃癌的辅助治疗。在非小细胞肺癌中,miR-451可通过抑制AKT信号通路的激活增加肺癌对顺铂的敏感度[10]。Liu等[11]发现过表达miR-451能够降低肺癌细胞对伊马替尼的耐药作用,提高TKI的疗效。此外,在乳腺癌中,他莫昔芬也可诱导miR-451的上调,降低肿瘤细胞的抵抗效果[12]。本研究发现,miR-451参与胃癌细胞对5-Fu的耐药作用。RT-PCR检测结果显示miR-451在非耐药胃癌中表达量高于耐药胃癌组织,CCK8实验显示miR-451参与调节胃癌细胞对5-Fu的耐药作用,证明miR-451可明显降低细胞对5-Fu的耐药性,并通过生物信息学分析的方法证明了耐药基因MRP为miR-451的靶基因,荧光素酶报告实验显示上调miR-451可明显抑制野生型MRP的荧光强度,RT-PCR以及Western blot实验验证了上调miR-451可抑制MRP的表达,而抑制miR-451可促进MRP的表达,表明miR-451通过与MRP的3'UTR结合直接调节其表达。MRP作为调节肿瘤细胞对各种药物的耐药作用已被证实,O'Meara等[13]发现MRP可能参与HIV耐药,MRP可通过影响抗HIV药物转运至转染的细胞中抑制药物对HIV的杀伤。Boumendjel等[14]发现MRP也可影响抗结核杆菌药物的转运,增加结核杆菌的耐药现象。以上说明MRP在耐药方面发挥广泛的作用。
本研究阐述了miR-451异常表达介导了胃癌细胞系对5-Fu的耐药作用,并通过生物信息学相关分析,证明了miR-451通过靶基因MRP影响胃癌细胞对5-Fu的耐药作用,为目前寻找胃癌耐药方面的治疗提供了新的思路以及依据。
Competing interests: The authors declare that they have no competing interests.作者贡献:汤良君:实验设计及实施,论文撰写孙艳、张晓红:实验实施盛少琴:实验评估 -
-
[1] Li X, Zheng R, Li X, et al. Trends of incidence rate and age at diagnosis for cervical cancer in China, from 2000 to 2014[J]. Chin J Cancer Res, 2017, 29(6): 477-486. doi: 10.21147/j.issn.1000-9604.2017.06.02
[2] Zhuang L, Liu F, Peng P, et al. Effect of Ku80 on the radiosensitization of cisplatin in the cervical carcinoma cell line HeLa[J]. Oncol Lett, 2018, 15(1): 147-154. http://europepmc.org/articles/PMC5766065/
[3] Drögemöller BI, Brooks B, Critchley C, et al. Further investigation of the role of ACYP2 and WFS1 pharmacogenomic variants in the development of cisplatin-induced ototoxicity in testicular cancer patients[J]. Clin Cancer Res, 2018, 24(8): 1866-1871. doi: 10.1158/1078-0432.CCR-17-2810
[4] Xu J, Zhang L, Shu G, et al. microRNA-16-5p promotes 3T3-L1 adipocyte differentiation through regulating EPT1[J]. BiochemBiophys Res Commun, 2019, 514(4): 1251-1256. doi: 10.1016/j.bbrc.2019.04.179
[5] Kim EA, Kim TG, Sung EG, et al. miR-148a increases the sensitivity to cisplatin by targeting Rab14 in renal cancer cells[J]. Int J Oncol, 2017, 50(3): 984-992. doi: 10.3892/ijo.2017.3851
[6] 陈元元, 唐铁雷, 程永刚, 等. miR-148a-3p、miR-128、miR-588在乳腺癌中的表达情况及其与耐药性的关系[J]. 现代肿瘤医学, 2019, 27(12): 2108-2113. doi: 10.3969/j.issn.1672-4992.2019.12.018 Chen YY, Tang TL, Cheng YG, et al. The differential expression of miR-148a-3p, miR-128, miR-588 and their association with chemo-resistance in breast cancer[J]. Xian Dai Zhong Liu Yi Xue, 2019, 27(12): 2108-2113. doi: 10.3969/j.issn.1672-4992.2019.12.018
[7] Yao T, Lu R, Zhang J, et al. Growth arrest-specific 5 attenuates cisplatin-induced apoptosis in cervical cancer by regulating STAT3 signaling via miR-21[J]. J Cell Physiol, 2019, 234(6): 9605-9615. doi: 10.1002/jcp.27647
[8] He M, Xue Y. MicroRNA-148a suppresses proliferation and invasion potential of non-small cell lung carcinomas via regulation of STAT3[J]. Onco Targets Ther, 2017, 10: 1353-1361. doi: 10.2147/OTT.S123518
[9] Sun H, Fan G, Deng C, et al. miR-4429 sensitized cervical cancer cells to irradiation by targeting RAD51[J]. J Cell Physiol, 2020, 235(1): 185-193. doi: 10.1002/jcp.28957
[10] Jang SH, Jung YJ, Kim MG, et al. The prognostic significance of compliance with postoperative adjuvant chemotherapy in patients with stage Ⅲ gastric cancer: an observational study[J]. J Gastric Cancer, 2018, 18(1): 48-57. doi: 10.5230/jgc.2018.18.e4
[11] Shahid F, Farooqui Z, Khan F. Cisplatin-induced gastrointestinal toxicity: an update on possible mechanisms and on available gastroprotective strategies[J]. Eur J Pharmacol, 2018, 827: 49-57. doi: 10.1016/j.ejphar.2018.03.009
[12] 文习之, 潘求忠, 翁德胜, 等. 聚乙二醇修饰脂质体阿霉素联合顺铂单次给药治疗晚期骨肉瘤的剂量递增试验[J]. 中山大学学报(医学科学版), 2020, 41(4): 582-588. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSYK202004011.htm Wen XZ, Pan QZ, Weng DS, et al. Pegylated liposomal doxorubicin combined with cisplatin for advanced osteosarcoma: a single-dose dose-escalating trial[J]. Zhongshan Da Xue Xue Bao (Yi Xue Ke Xue Ban), 2020, 41(4): 582-588. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSYK202004011.htm
[13] Potestà M, Roglia V, Fanelli M, et al. Effect of microvesicles from Moringa oleifera containing miRNA on proliferation and apoptosis in tumor cell lines[J]. Cell Death Discov, 2020, 6: 43. http://www.nature.com/articles/s41420-020-0271-6
[14] Du B, Wang X, Wu D, et al. MicroRNA expression profiles identify biomarkers for predicting the response to chemoradiotherapy in rectal cancer[J]. Mol Med Rep, 2018, 18(2): 1909-1916. http://europepmc.org/abstract/MED/29956755
[15] 李航, 姜勉, 樊赛军. MiR-148a对肺癌细胞放射敏感性的影响[J]. 国际放射医学核医学杂志, 2018, 42(3): 248-256. doi: 10.3760/cma.j.issn.1673-4114.2018.03.010 Li H, Jiang M, Fan SJ. Effect of miR-148a on the radiosensitivity of lung cancer cells[J]. Guo Ji Fang She Yi Xue He Yi Xue Za Zhi, 2018, 42(3): 248-256. doi: 10.3760/cma.j.issn.1673-4114.2018.03.010
[16] Li B, Wang W, Li Z, et al. MicroRNA-148a-3p enhances cisplatin cytotoxicity in gastric cancer through mitochondrial fission induction and cyto-protective autophagy suppression[J]. Cancer Lett, 2017, 410: 212-227. doi: 10.1016/j.canlet.2017.09.035
[17] 胡轶, 李雄, 蒋桂英, 等. 曲古抑菌素A下调STAT3增强卵巢癌细胞顺铂化疗敏感性的体外研究[J]. 华中科技大学学报(医学版), 2019, 48(3): 253-257. doi: 10.3870/j.issn.1672-0741.2019.03.001 Hu Y, Li X, Jiang GY, et al. Tragomycin A Enhances Chemosensitivity to Cisplatin in Ovarian Cancer Cell Lines by Down-regulating STAT3[J]. Hua Zhong Ke Ji Da Xue Xue Bao (Yi Xue Ban), 2019, 48(3): 253-257. doi: 10.3870/j.issn.1672-0741.2019.03.001
[18] Wu B, Wang R, Li S, et al. Antifibrotic effects of Fraxetin on carbon tetrachloride-induced liver fibrosis by targeting NF-κB/IκBα, MAPKs and Bcl-2/Bax pathways[J]. Pharmacol Rep, 2019, 71(3): 409-416. doi: 10.1016/j.pharep.2019.01.008
[19] Zhang Y, Yang X, Ge X, et al. Puerarin attenuates neurological deficits via Bcl-2/Bax/cleaved caspase-3 and Sirt3/SOD2 apoptotic pathways in subarachnoid hemorrhage mice[J]. Biomed Pharmacother, 2019, 109: 726-733. doi: 10.1016/j.biopha.2018.10.161
[20] Zhong Q, Hu Z, Li Q, et al. Cyclin D1 silencing impairs DNA double strand break repair, sensitizes BRCA1 wildtype ovarian cancer cells to olaparib[J]. Gynecol Oncol, 2019, 152(1): 157-165. doi: 10.1016/j.ygyno.2018.10.027
-
期刊类型引用(3)
1. 金勋,方家豪. 宫颈癌组织微小RNA-99b表达与患者临床病理及信号转导和转录激活因子3/血管内皮生长因子通路相关性分析. 中国妇幼保健. 2025(02): 326-329 .  百度学术
百度学术
2. 拓明花,孙兴文,赵文慧,马鸿云. 宫颈HPV持续感染临床特征及宫颈脱落细胞中miR-148a-3p、Pax 1、LMX 1A表达的诊断价值. 中华医院感染学杂志. 2024(14): 2183-2187 .  百度学术
百度学术
3. 杨俊,祝徳,段智慧,张子月. miR-140抑制卵巢癌细胞增殖促进卵巢癌细胞凋亡及靶向抑制CMTM6表达. 中国组织化学与细胞化学杂志. 2022(06): 582-591 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载: