Mechanism of HIF-1α Promoting Malignant Development of Nasopharyngeal Carcinoma by Upregulating PD-L1 Under Hypoxic Conditions
-
摘要:目的
探讨乏氧条件下HIF-1α通过上调PD-L1促进鼻咽癌恶性发展的机制。
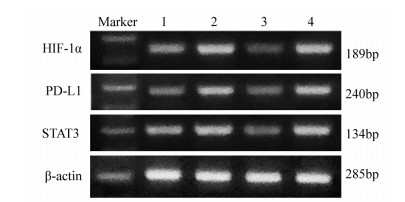
方法选取人类鼻咽癌细胞系CNE2细胞进行实验。设置常氧组(20%O2)、乏氧组(1%O2)、HIF-1α-siRNA+乏氧组和NC-siRNA+乏氧组。MTT实验检测各组细胞增殖率;流式细胞术检测各组细胞凋亡;RT-PCR检测各组细胞中HIF-1α、STAT3和PD-L1 mRNA表达的变化;Western blot检测不同处理条件下各组细胞HIF-1α、STAT3和PD-L1蛋白表达的变化及STAT3磷酸化情况。
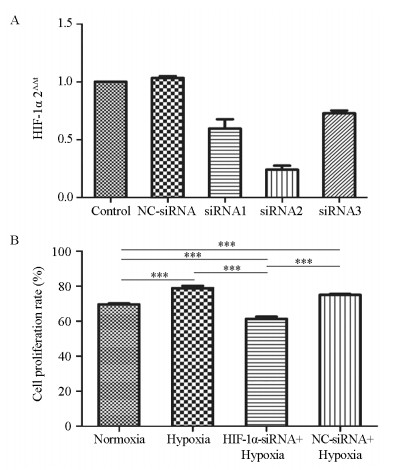
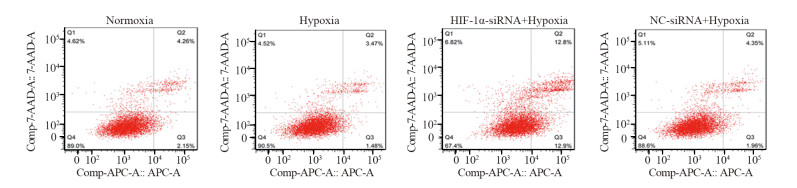
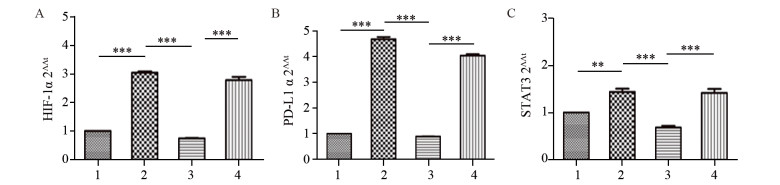
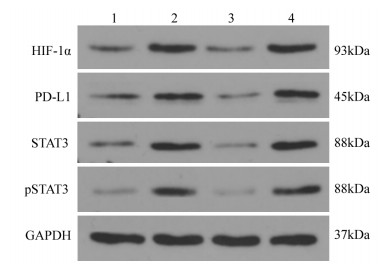
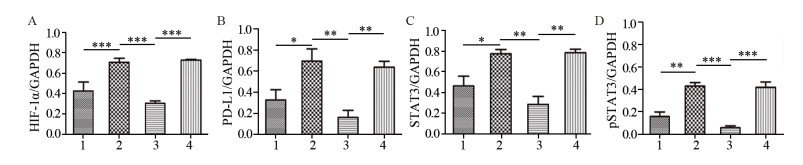
结果MTT实验显示,乏氧组和转染细胞增殖率显著高于常氧组(P=0.000),HIF-1α-siRNA+乏氧组的细胞增殖率明显低于常氧组、乏氧组和NC-siRNA+乏氧组(P=0.000)。流式分析显示,HIF-1α-siRNA+乏氧组的细胞凋亡率显著高于其他三组(P=0.001)。RT-PCR检测显示,HIF-1α-siRNA+乏氧组的HIF-1α、PD-L1和STAT3 mRNA水平显著低于乏氧组和NC-siRNA+乏氧组。蛋白印迹结果显示,HIF-1α、PD-L1和STAT3蛋白表达趋势与mRNA分子水平趋势一致。HIF-1α-siRNA+乏氧组pSTAT3蛋白水平也显著低于乏氧组和NC-siRNA+乏氧组(P=0.001)。
结论乏氧微环境下HIF-1α有可能通过STAT3上调PD-L1表达,进而促进癌细胞免疫逃逸,导致鼻咽癌恶性发展。
Abstract:ObjectiveTo explore the mechanism of HIF-1α promoting malignant development of nasopharyngeal carcinoma by upregulating PD-L1 expression under hypoxic conditions.
MethodsCNE2 cells were divided into normoxia (20%O2), hypoxia (1%O2), HIF-1α-siRNA+hypoxia and NC-siRNA+hypoxia groups. Cell proliferation, apoptosis, the mRNA levels of HIF-1α, STAT3 and PD-L1, the protein levels of HIF-1α, PD-L1, STAT3 and STAT3 phosphorylation were detected by MTT assay, flow cytometry, RT-PCR and Western blot, respectively.
ResultsCell proliferation of hypoxia group was significantly higher than that of normoxia group (P=0.000). The cell proliferation rate of HIF-1α-siRNA+hypoxia group was significantly lower than those in other groups (P=0.000). The apoptosis rate of HIF-1α-siRNA+hypoxia group was remarkably higher than those in other groups (P=0.001). RT-PCR detection showed that the mRNA levels of HIF-1α, PD-L1 and STAT3 in the HIF-1α-siRNA+hypoxia group were significantly lower than those in hypoxia group and NC-siRNA+hypoxia group. The protein expression of HIF-1α, PD-L1 and STAT3 showed similar tendency in Western blot assays compared with the mRNA levels. The pSTAT3 protein expression level in HIF-1α-siRNA+hypoxia group was significantly lower than those in hypoxia group and HIF-1α-siRNA+hypoxia group (P=0.001).
ConclusionUnder hypoxic microenvironment, HIF-1α may up-regulate the expression of PD-L1 through STAT3, thereby promoting the immune escape of cancer cells, leading to the malignant development of nasopharyngeal carcinoma.
-
Key words:
- PD-L1 /
- HIF-1α /
- Nasopharyngeal carcinoma /
- Hypoxia
-
0 引言
骨肉瘤(osteosarcoma, OS)是一种起源于骨髓间充质干细胞的恶性骨肿瘤,好发于儿童以及青少年[1]。骨肉瘤的高异质性、恶性发展、易转移导致患者预后较差[2-3]。目前骨肉瘤的确切发病机制尚不清楚,流行病学调查研究发现,除了青春期的生长因子和激素水平异常、病毒感染、环境危险因素(如氟化物、辐射等外源性刺激)以外,还与基因突变密切相关[4]。但诸多研究表明遗传易感性与骨肉瘤的发生发展密切相关[5]。单核苷酸多态性(single nucleotide polymorphisms, SNPs)是个体间最常见的遗传变异类型,分布于基因编码区、非编码区及基因间区[6],可作为潜在的分子标志物反映肿瘤的易感性[7]。
随着全基因组关联研究结果的不断丰富,越来越多的易感基因在骨肉瘤的发生发展和预后中的重要作用被证实[8]。目前,针对骨肉瘤易感性的研究结论主要来源于SNP分析、全基因组关联分析,本研究针对上述分析结果进行系统性综述,以期为探索可靠生物标志物提供新的理论依据。
1 全基因组关联分析研究
全基因组关联分析研究(genome-wide association study, GWAS)是将基因组的单核苷酸多态性进行标记,通过对照和相关性分析筛选影响不同性状的基因变异的方法,目前GWAS已成为探索疾病遗传易感性和筛选生物标志物的可靠工具。本研究从TCGA公共数据库中对102例骨肉瘤患者的体细胞突变进行分析,最终得到3 167个基因SNPs。在骨肉瘤患者的3种基因变异类型中,错义突变最多,为2 076个,其次为无义突变、移码缺失,见图1。基因突变类型中SNP突变基因数量最多,为2 268个。碱基突变类型中,C基因型突变为T基因型占比最多,为1 436个。进一步对102例骨肉瘤患者的SNPs进行聚类分析,依次获得发生突变比例由大到小的基因,如TP53的突变比例最高,102例骨肉瘤患者中有21%患者的TP53发生了突变,见图2。提示错义突变、SNP基因突变、C>T、TP53突变提高患骨肉瘤风险,但由于骨肉瘤异质性较强,本研究结果仅能解释部分遗传突变信息,还有大量遗传信息的变异需要进一步深入挖掘。结合上述研究结果,本综述继续对既往骨肉瘤基因多态性研究进行系统性分析,深入探索基因组单核苷酸多态性在骨肉瘤恶性表征中的生物学作用,挖掘骨肉瘤发生发展的遗传学机制。
2 单核苷酸多态性
2.1 癌基因多态性
细胞因子是一类多效介质,如白细胞介素(interleukin, IL)、肿瘤坏死因子(tumor necrosis factor, TNF)、生长因子(growth factor, GF)等,通过旁分泌和(或)自分泌方式调控免疫反应、炎症反应,驱动肿瘤的发生、转移、浸润等生物学过程[8-9]。有研究表明,IL-6-172位点rs1800795显性模型GC和CC会增加骨肉瘤发生风险[10]。IL-8-251 rs4073 AA基因型频率在骨肉瘤发生肺转移患者中较高,且与rs4073 TT基因型相比,显性模型TA和AA基因型个体患骨肉瘤的风险显著增高[11]。IL-10-1082(rs1800896)A>G基因型和等位基因频率在骨肉瘤患者和对照组之间存在显著差异。与AA基因型相比,显性模型AG和GG基因型合并发生骨肉瘤的风险显著增加[12]。但有关IL家族基因多态性与骨肉瘤易感性之间的研究尚不充分,期待更多的研究进一步阐明IL基因多态性调控骨肉瘤恶性表征的分子机制,为后续探索骨肉瘤生物标志物提供新的依据。
TNF是一种常见的肿瘤标志物。一项Meta分析结果证明,TNF-α 308(rs1800629)G>A多态性与骨肉瘤易感性增加显著相关,TNF-β 252A/G和TGF-β1 29T/C与骨肉瘤风险无关[13]。Sghaier等研究发现,TNF-α 238G/A在不同人群中发挥不同的生物学作用,在白种人群中,TNF-α 238G/A可显著降低骨肉瘤的易感性,但在亚洲人群中尚未发现两者的相关性[14],提示对于不同种族和不同TNF亚型的研究不足,仍需要进一步研究。
PIK3CA和Akt是PI3K/Akt信号通路的重要组成部分,在调控细胞增殖和凋亡过程中发挥癌基因的作用。He等研究显示,rs7646409位于PIK3CA基因内含子区域,与TT基因型相比,CC基因型可显著增加骨肉瘤的发生风险,提示PIK3CA rs7646409通过PI3K/Akt/mTOR/p70s6k(核糖体蛋白)通路,重建肌动蛋白丝,进而增强肿瘤细胞活力;同样地,Akt1活性增强通过刺激NF-κB转录,激活肿瘤细胞活力,继而促进肿瘤细胞恶性增殖;此外,PI3K/Akt/mTOR通路上调基质金属蛋白酶-2表达,激活细胞外基质的降解,促进肿瘤转移[15]。细胞毒性T淋巴细胞相关蛋白4基因(cytotoxic T lymphocyte-associated antigen-4, CTLA4)是抑制T淋巴细胞功能的关键表面标志物,研究表明,其表达增加可减弱抗肿瘤反应,最终增加个体癌症易感性[16]。已有研究证实,在中国人群中CTLA4位点rs231775 AA基因型与骨肉瘤患病风险增加相关[17]。另一些致癌信号通路,如JAK-STAT、Wnt、Ras等信号通路在骨肉瘤的发生机制、进展过程中发挥至关重要的作用,但其SNPs在骨肉瘤中的易感性研究尚未见报道,因此信号通路的SNPs可作为骨肉瘤癌基因的一个研究重点,为后续研发通路相关突变靶点药物用于临床个性化治疗提供思路。
2.2 抑癌基因多态性
抑癌基因作为癌症发生的负调控基因,其SNPs可能导致抑癌功能丧失。研究表明,细胞因子家族中的生长因子(growth factor, GF)通过与高特异性的细胞膜受体结合,调节细胞生长、分化、迁移等多种过程,继而发挥抑癌基因的作用[18],如生长激素1(growth hormone 1, GH1)基因 rs11079515 G>C和rs7921 A>C个体患骨肉瘤的风险较低;此外,成纤维细胞生长因子-2(fibroblast growth factor 2, FGF-2)、成纤维细胞生长因子受体3(fibroblast growth factor receptor 3, FGFR3)、促性腺激素释放激素-2(gonadotropin-releasing hormone 2, GNRH-2)、胰岛素样生长因子-1(insulin-like growth factor 1, IGF-1)和血管内皮生长因子(vascular endothelial growth factor, VEGF)突变与骨肉瘤易感性显著相关[19]。FGF-2基因中rs11737764等位基因A出现的频率高与骨肉瘤风险增加相关[20]。IGF-1(rs6218)T>C中,携带TT纯合子基因型个体患骨肉瘤的风险显著降低[21]。携带VEGF基因rs699947-2578 CC基因型的个体患骨肉瘤的易感性减弱[22]。尽管部分抑癌基因的位点易感性已有报道,但由于研究样本量的局限性、骨肉瘤的高异质性、统计效能较低导致的假阳性率和假阴性率异常等原因,已被报道的SNP未能得到充分的验证。
TP53(tumor protein p53)是一种肿瘤抑制基因,在调节细胞分裂、预防肿瘤形成中起重要作用。TP53基因编码肿瘤抑制蛋白p53,通过调控细胞凋亡和基因组稳定性、抑制血管生成等发挥抗肿瘤作用。Huang等研究发现,TP53 rs1042522 C>G多态性是恶性骨肿瘤的遗传危险因素,与CC基因型受试者相比,GG基因型受试者骨肉瘤发生风险显著增加[23]。转录因子21(transcription factor 21, TCF21)在控制细胞发育和分化中起着重要的作用,有研究表明TCF21 rs12190287 C>G中,以CC纯合子基因型作为对照组,CG和GG基因型显著增加骨肉瘤患病风险,提示TCF21抑癌基因的位点突变导致骨肉瘤易感性的增加;且rs12190287多态性与骨肉瘤的Enneking GTM临床分级相关[24]。RASSF1A蛋白具有抑制细胞周期蛋白D1积累的能力,从而诱导细胞周期阻滞。RASSF1A rs1989839 C>T与骨肉瘤风险升高相关,CT基因型及TT基因型与骨肉瘤发生风险升高相关[25]。DNA修复相关基因XRCC3(X-ray repair cross complementing 3)促使受损DNA结构及功能恢复原样,若DNA修复机制出现编码和功能错误,引发细胞凋亡紊乱,最终导致癌变。XRCC3外显子多态性调控苏氨酸-蛋氨酸功能,进而影响DNA修复能力。Guo等基于病例随机对照试验证明,XRCC3 Thr241Met rs861539 C>T基因型的个体发生骨肉瘤的风险显著高于Thr/Thr基因型[26]。内切酶ERCC1基因(excision repair cross complement 1)位于19q13.3,能够催化5'-3'切口,是核酸切除修复通路的关键限速酶。而ERCC1(T>C rs11615)与骨肉瘤预后改善相关,等位基因T突变为C后骨肉瘤的易感增加性[27]。
脱嘌呤/脱嘧啶核酸内切酶1(apurinic/apyrimidinic endonuclease 1, APE1)是一种多功能蛋白,通过移除DNA损伤、调控转录因子激活,参与调控炎性反应、细胞生长、远端迁移和血管生成等生物学过程。APE1基因rs1760944 T>G通过干扰APE1基因的转录和翻译,降低骨肉瘤的患病风险[28]。整合素(Integrin)是一类由18个α-亚基和8个β-亚基组合的细胞表面受体,参与细胞与细胞外基质的黏附,对实体肿瘤的发生进展和转移至关重要[29]。研究发现携带ITGA3 rs2230392 AA基因型的男性个体患骨肉瘤风险更高,与GG基因型患者相比,AA基因型男性患者发生骨肉瘤转移的风险增加了两倍[30]。抑癌基因是骨肉瘤易感性的重要遗传因素,为进一步阐明抑癌基因SNPs在骨肉瘤恶性增殖、免疫逃避、远端转移、血管生成等过程中的作用,需要进一步在更多人群中进行验证。
2.3 miRNA相关基因多态性
miRNA是一类短链非编码RNA,既可作为抑癌基因,也可作为致癌基因参与调控癌症的发生发展过程[31]。Lv等研究发现,miR-34a rs72631823 G>A中的罕见等位基因A与骨肉瘤患病风险显著相关[32];另有一项研究发现,携带miR-124a rs531564 CG及GG基因型的个体患骨肉瘤风险较低[33]。Tian等研究表明,miR-491-5p rs1056628 A>C可作新兴生物标志物预测骨肉瘤肺转移[34]。目前针对miRNAs SNPs的研究较少,其功能尚不明确,仍需进一步深入研究。
3 总结及展望
基因多态性是影响骨肉瘤发生发展的重要因素。随着GWAS技术不断为遗传变异研究提供重要线索,基因多态性在骨肉瘤中的重要作用逐渐被发现,为其作为生物标志物预测骨肉瘤发生发展、预警患者预后提供了新的理论依据。
然而,本研究仍具有一些局限性:(1)由于纳入研究的对象多样性,造成研究结果的不一致,如TNF-α 238G/A多态性是高加索人群骨肉瘤易感性的保护性因素,而在国内一项病例对照试验中未得到证明[35],无法全面阐明TNF多态性与骨肉瘤易感性之间的相关性;(2)基因多态性在骨肉瘤中的作用机制尚不明确,无法详细解释其在骨肉瘤发生发展中的作用;(3)骨肉瘤的发生发展是由多种因素所致,但目前较多研究局限于单个遗传因素,并未将多种因素的交互作用纳入分析,因此未来的研究应基于更全面的数据,协同多个因素更全面地了解骨肉瘤的遗传和致病机制,为寻找骨肉瘤发生、发展、预后的潜在有效生物标志物提供重要的理论依据。
Competing interests: The authors declare that they have no Competing interests.作者贡献:蒋豆豆:实验操作及论文撰写董佳文:实验操作胡德胜、周亚娟:实验设计及指导 -
表 1 转染序列
Table 1 Transfection sequence

表 2 引物序列及扩增片段长度
Table 2 Primer sequence and amplified fragment length

-
[1] 许珊, 姜学钧. Dicer1低表达与鼻咽癌患者预后的关联性研究[J]. 临床耳鼻咽喉头颈外科杂志, 2015, 29(2): 126-131. https://www.cnki.com.cn/Article/CJFDTOTAL-LCEH201502009.htm Xu S, Jiang XY. Reduced expression of Diceri is associated with Poor Prognosis in Patients with nasopharyngeal carcinoma[J]. Lin Chuang Er Bi Yan Hou Tou Jing Wai Ke Za Zhi, 2015, 29(2): 126-131. https://www.cnki.com.cn/Article/CJFDTOTAL-LCEH201502009.htm
[2] Lee C, Park SH, Yoon SY, et al. Gamma Knife Radiosurgery Using Co-Registration with PET-CT and MRI for Recurrent Nasopharyngeal Carcinoma with Previous Radiotherapy: A Single Center 14-Year Experience[J]. J Korean Neurosurg Soc, 2020, 63(3): 397-405. doi: 10.3340/jkns.2019.0011
[3] Liang XX, Li Q, Su Z, et al. Significant Prognostic impact of chemoradiotherapy-induced hemoglobin decrease on treatment outcomes of nasopharyngeal carcinoma[J]. J Cancer, 2015, 6(6): 502-510. doi: 10.7150/jca.11403
[4] Wong EHC, Liew YT, Loong SP, et al. Five-year Survival Data on the Role of Endoscopic Endonasal Nasopharyngectomy in Advanced Recurrent rT3 and rT4 Nasopharyngeal Carcinoma[J]. Ann Otol Rhinol Laryngol, 2020, 129(3): 287-293. doi: 10.1177/0003489419887410
[5] Xu Q, Briggs J, Park S, et al. Targeting Stat3 blocks both HIF-1 and VEGF expression induced by multiple oncogenic growth signaling Pathways[J]. Oncogene, 2005, 24(36): 5552-5560. doi: 10.1038/sj.onc.1208719
[6] 乌日罕, 呼群, 马强, 等. PD-1和PD-L1在肿瘤免疫逃逸中的作用机制及临床意义[J]. 现代肿瘤医学, 2019, 27(9): 1635-1638. doi: 10.3969/j.issn.1672-4992.2019.09.040 Wu RH, Hu Q, Ma Q, et al. Clinical significance and mechanism of PD-1 and PD-L1 in cancer immune escape[J]. Xian Dai Zhong Liu Yi Xue, 2019, 27(9): 1635-1638. doi: 10.3969/j.issn.1672-4992.2019.09.040
[7] Chen TC, Wu CT, Wang CP, et al. Associations among Pretreatment tumor necrosis and the expression of HIF-1alPha and PD-L1 in advanced oral squamous cell carcinoma and the Prognostic impact thereof[J]. Oral Oncol, 2015, 51(11): 1004-1010. doi: 10.1016/j.oraloncology.2015.08.011
[8] Chang YL, Yang CY, Lin MW, et al. High co-expression of PD-L1 and HIF-1α correlates with tumour necrosis in Pulmonary Pleomorphic carcinoma[J]. Eur J Cancer, 2016, 60: 125-135. doi: 10.1016/j.ejca.2016.03.012
[9] Han S, Yin X, Wang Y, et al. Co-expression of HIF-1 and TLR3 is associated with Poor Prognosis in oral squamous cell carcinoma[J]. Int J Clin Exp Pathol, 2020, 13(1): 65-72. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_PM32055274
[10] Masoud GN, Li W. HIF-1alPha Pathway: role, regulation and intervention for cancer therapy[J]. Acta Pharm Sin B, 2015, 5(5): 378-389. doi: 10.1016/j.apsb.2015.05.007
[11] Wong CA, McCarthy RJ, Fitzgerald PC, et al. Gastric emptying of water in obese Pregnant women at term[J]. Anesth Analg, 2007, 105(3): 751-755. doi: 10.1213/01.ane.0000278136.98611.d6
[12] Noman MZ, Desantis G, Janji B, et al. PD-L1 is a novel direct target of HIF-1alPha, and its blockade under hypoxia enhanced MDSC-mediated T cell activation[J]. Exp Med, 2014, 211(5): 781-790. doi: 10.1084/jem.20131916
[13] Daniel SK, Sullivan KM, Labadie KP, et al. Hypoxia as a barrier to immunotherapy in Pancreatic adenocarcinoma[J]. Clin Transl Med, 2019, 8(1): 10. doi: 10.1186/s40169-019-0226-9/fulltext.html
[14] Barsoum IB, Smallwood CA, Siemens DR, et al. A mechanism of hypoxia-mediated escaPe from adaptive immunity in cancer cells[J]. Cancer Res, 2014, 74(3): 665-674. doi: 10.1158/0008-5472.CAN-13-0992
[15] Minichsdorfer C, Oberndorfer F, Krall C, et al. PD-L1 Expression on Tumor Cells Is Associated With a Poor Outcome in a Cohort of Caucasian Nasopharyngeal Carcinoma Patients[J]. Front Oncol, 2019, 9(6): 1334. http://www.ncbi.nlm.nih.gov/pubmed/31850219
[16] Messai Y, Gad S, Noman MZ, et al. Renal Cell Carcinoma Programmed Death-ligand 1, a New Direct Target of Hypoxia-inducible Factor-2 Alha, is Regulated by von HiPPel-Lindau Gene Mutation Status[J]. Eur Urol, 2016, 70(4): 623-632. doi: 10.1016/j.eururo.2015.11.029
[17] Li X, Li C, Zhou P, et al. Inhibitory effect of icaritin on Proliferation, migration, and invasion of human nasopharyngeal carcinoma cell CNE2 by regulating STAT3 activation[J]. Pharmazie, 2019, 74(11): 685-687. http://www.ncbi.nlm.nih.gov/pubmed/31739838
[18] Xing Y, Mi C, Wang Z, et al. Fraxinellone has anticancer activity in vivo by inhibiting Programmed cell death-ligand 1 expression by reducing hypoxia-inducible factor-1α and STAT3[J]. Pharmacol Res, 2018, 135: 166-180. doi: 10.1016/j.phrs.2018.08.004
[19] Frank A, Bonney M, Bonney S, et al. Myocardial ischemia reperfusion injury: from basic science to clinical bedside[J]. Semin Cardiothoracic Vasc Anesth, 2012, 16(3): 123-132. doi: 10.1177/1089253211436350
[20] Zhou Y, Miao J, Wu H, et al. PD-1 and PD-L1 expression in 132 recurrent nasopharynx-geal carcinoma: the correlation with anemia and outcomes[J]. Oncotarget, 2017, 8(31): 51210-51223. doi: 10.18632/oncotarget.17214
[21] Makowska A, Braunschweig T, Denecke B, et al. Interferon β and Anti-PD-1/PD-L1 Checkpoint Blockade Cooperate in NK Cell-Mediated Killing of Nasopharyngeal Carcinoma Cells[J]. Transl Oncol, 2019, 12(9): 1237-1256. doi: 10.1016/j.tranon.2019.04.017
[22] Masterson L, Howard J, Gonzalez-Cruz J, et al. Immune checkpoint inhibitors in advanced nasopharyngeal carcinoma: Beyond an era of chemoradiation[J]. Int J Cancer, 2020, 146(8): 2305-2314. doi: 10.1002/ijc.32869
[23] 江蓉, 邱艳芳, 王晖, 等. PD-L1蛋白在鼻咽癌中的表达及其临床意义[J]. 中国耳鼻咽喉颅底外科杂志, 2018, 24(6): 561-564, 570. https://www.cnki.com.cn/Article/CJFDTOTAL-ZEBY201806018.htm Jiang R, Qiu YF, Wang H, et al. Expression and clinical significance of PD-L1 protein in nasopharyngeal carcinoma[J]. Zhongguo Er Bi Yan Hou Lu Di Wai Ke Za Zhi, 2018, 24(6): 561-564, 570. https://www.cnki.com.cn/Article/CJFDTOTAL-ZEBY201806018.htm




 下载:
下载: