Clinical Analysis of Oxaliplatin-related Thrombocytopenia in Patients with Digestive System Malignancy
-
摘要:目的
探讨消化系统恶性肿瘤患者在接受含奥沙利铂方案化疗后血小板计数及脾脏直径的变化趋势,及其相关性。
方法回顾性分析72例消化系统肿瘤患者临床资料,测量及分析患者治疗期间及治疗后血小板数值及脾脏直径的变化。
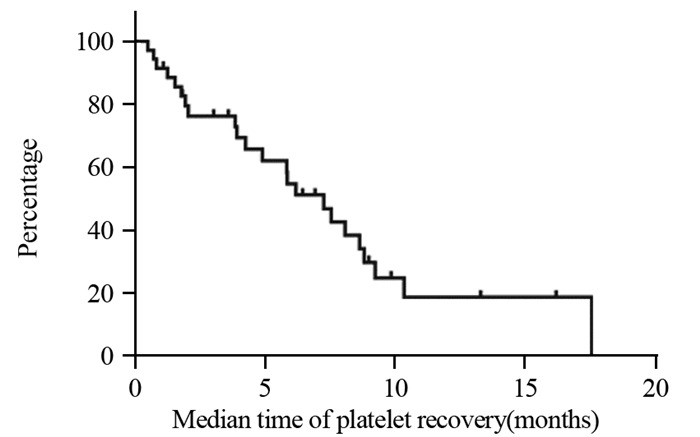
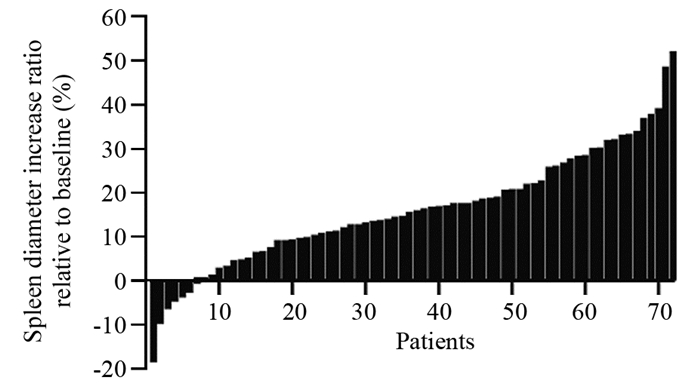
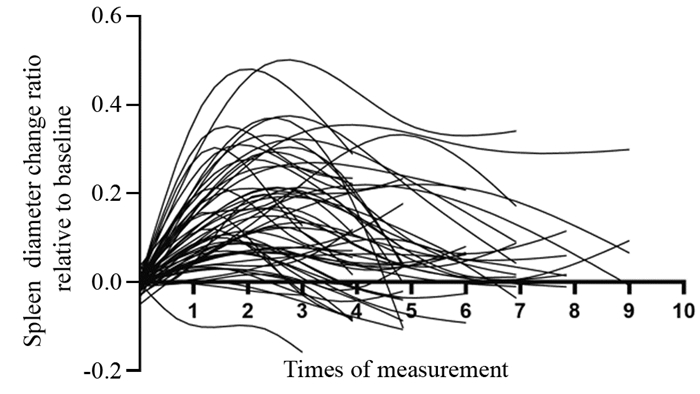
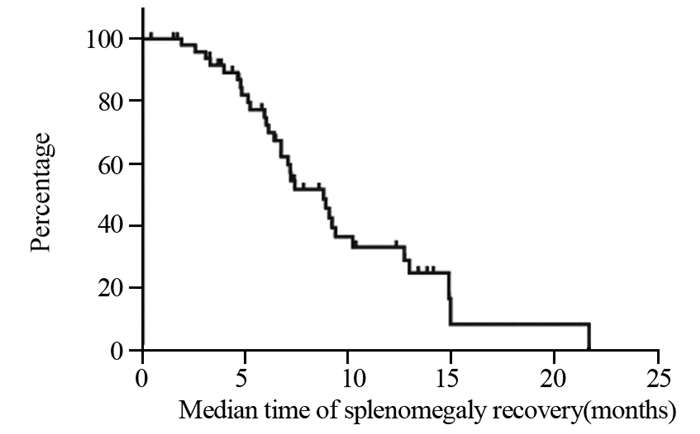
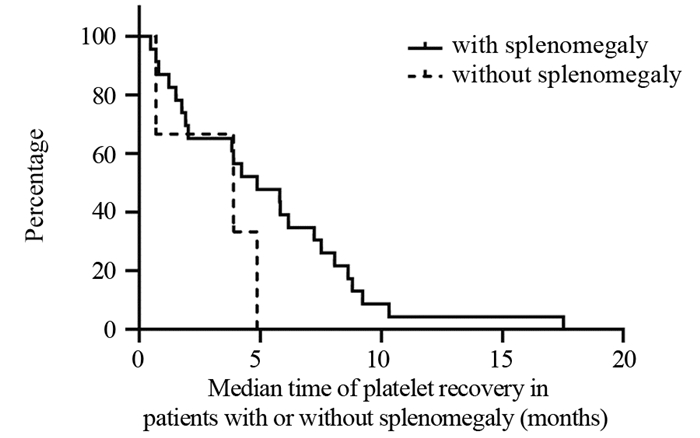
结果全组72例患者各级血小板下降发生率为65.3%。化疗开始后血小板下降的中位发生时间为2.53±0.49月,中位奥沙利铂累积剂量为520±35.81 mg/m2;化疗开始后血小板最低值出现的中位时间为4.03±0.49月,中位奥沙利铂累积剂量为780±36.32 mg/m2。共有52例(72.2%)患者出现不同程度的脾脏增大;中位增大比例为(18.82±0.01)%。化疗开始后开始出现脾脏增大的中位时间为2.15±0.19月,脾脏直径最大的中位时间为4.68±2.89月,化疗结束后脾脏开始缩小的中位时间为3.28±0.44月,化疗结束后脾脏恢复的中位时间为8.80±1.05月。
结论含奥沙利铂方案的化疗可引起血小板下降、脾脏肿大,并且在化疗结束后较长时间难以恢复到基线水平。脾脏径线增加与脾肿大和血小板下降具有显著相关性。
Abstract:ObjectiveTo investigate the changing trend and correlation of platelet count and spleen diameter in patients with digestive system malignancy receiving oxaliplatin-based chemotherapy.
MethodsWe retrospectively analyzed clinical data of 72 patients with digestive system cancer, recorded and analyzed platelet count and spleen diameter during and after oxaliplatin-based chemotherapy.
ResultsThe incidence of thrombocytopenia in all patients was 65.3%. The median time of thrombocytopenia after the beginning of chemotherapy was 2.53±0.49 months, and the median cumulative dose of oxaliplatin was 520±35.81 mg/m2; the median time of lowest platelet count after the beginning of chemotherapy was 4.03±0.49 months, and the median cumulative dose of oxaliplatin was 780±36.32 mg/m2. Splenomegaly occurred in 52(72.2%) patients during the follow-up. The median increase rate was (18.82±0.01)%. The median time of splenomegaly after the beginning of chemotherapy was 2.15±0.19 months, the median time for the largest spleen diameter was 4.68±2.89 months; after the end of chemotherapy, the median time for spleen contraction was 3.28±0.44 months, and the median time for spleen recovery was 8.80±1.05 months.
ConclusionOxaliplatin-based chemotherapy can cause thrombocytopenia and splenomegaly, and it is difficult to recover to baseline for a long time after the end of chemotherapy. The increase of spleen diameter was positively correlated with splenomegaly and thrombocytosis.
-
Key words:
- Chemotherapy /
- Oxaliplatin /
- Sinusoidal obstruction syndrome /
- Splenomegaly /
- Thrombocytopenia
-
0 引言
辅助化疗的疗效已经得到肯定并且被广泛使用。全膀胱术后进行辅助化疗的目的是减少局部或远处复发[1]。但是其缺点在于可能延误对微转移灶的清除以及碍于全膀胱手术的并发症而无法给予全量化疗[2]。目前,多个回顾性研究证实了辅助化疗可以显著提高无复发生存率和总生存期[3-6]。但是由于证据级别较低,辅助化疗还不能作为全膀胱术后的标准治疗方案[7]。此外,在乳腺癌等疾病中,有研究已经证实了新辅助和辅助化疗具有相同的疗效[8]。然而,在肌层浸润性膀胱癌中还没有相关报道。仅有的几项回顾性研究比较了新辅助和辅助化疗的疗效,但是使用的化疗方案并不是常见的GC方案[4-6]。
因此我们提出假设,对于肌层浸润性膀胱癌患者接受全膀胱手术及新辅助或辅助化疗后具有相同的临床疗效。
1 资料与方法
1.1 病例收集
收集湖北省肿瘤医院泌尿外科2009年1月—2016年9月诊断为T2-4N0-2M0的38例接受了全膀胱切除+新辅助/辅助化疗(GC方案)的肌层浸润性膀胱癌患者。所有患者在术前进行诊断性电切治疗后均有病理结果证实肌层浸润。非肌层浸润性膀胱癌、有远处转移或合并上尿路肿瘤的患者是主要的排除标准。手术方案为膀胱全切除+盆腔淋巴结清扫,其范围包括髂内、髂外淋巴结、闭孔及髂总淋巴结。
无论是新辅助或辅助方案均为四个周期的GC方案。患者接受吉西他滨(1 000 mg/m2, d1、8、15)+顺铂(70 mg/m2, d1)静脉输液治疗。化疗间隔为4周。每次化疗前所有患者均进行实验室检测,顺铂剂量的调整需要根据血肌酐清除率的数值。当患者白细胞低于2 000/mm3或血小板低于5×104/mm3或3级及以上的非血液性毒性反应时,将调整吉西他滨的使用剂量(第8和15天停用)。
在新辅助化疗组中,患者在接受化疗前需要进行彻底的经尿道膀胱肿瘤电切治疗(TURBT)。所有患者在接受两个周期的化疗后会进行影像学评估,包括腹部和盆腔CT扫描或磁共振扫描。如果没有出现肿瘤缩小,则立即停止新辅助化疗并接受挽救性全膀胱切除术。新辅助化疗后的疗效反应使用RECIST(response evaluation criteria in solid tumor)评分量表完成。
1.2 围手术期评价指标
收集分析患者的年龄、性别、既往史、随访时间、病理结果(肿瘤大小、部位、细胞学类型和Fuhrman分级)。此外,主要研究终点为患者的无复发生存率(recurrence-free survival, RFS),次要研究终点为病理完全反应率(pathological complete response, pCR)。患者化疗期间的不良反应也进行了分析。
1.3 统计学方法
RFS和qCR使用Kaplan-Meier方法进行比较。两组患者RFS的比较使用Log rank测验方程。组间比较使用χ2检验。两组患者间化疗方案的比较使用Mann-Whitney U检验。P < 0.05表示差异有统计学意义,所有检验均为双侧。统计软件使用SigmaPlot 12.5版本。
2 结果
2.1 患者临床资料统计
新辅助化疗组平均年龄(66±15.2)岁,辅助化疗组(62±12.3)岁。两组患者的性别(P=0.015)和临床淋巴结分期(P=0.022)差异有统计学意义。新辅助化疗组较辅助化疗组患者平均年龄更大、临床分期更低,但是差异无统计学意义。患者的其他临床资料见表 1。
表 1 38例肌层浸润性膀胱癌患者临床资料Table 1 Characteristics of 38 muscle-invasive bladder cancer patients
2.2 两种治疗方案对患者预后的影响
所有患者的平均随访时间为30.6月,两组间平均随访时间(新辅助28.8月vs.辅助34.7月)相比差异无统计学意义(P=0.225)。在随访时间内,有13例患者(新辅助8例,辅助5例)出现复发或远处转移。患者术后的生存情况见图 1,新辅助化疗和辅助化疗组在中位随访时间的RFS分别是69.6%和75.4%,组间比较差异无统计学意义(P=0.223)。
2.3 接受化疗后的不良反应
GC方案化疗后血液学不良反应较常见,在辅助化疗组中,有3例患者出现严重的贫血症状、5例出现严重的血小板减少症、7例出现严重的中性粒细胞减少症。相对应地,在新辅助化疗组中的患者分别是5例、7例和5例。组间比较差异均无统计学意义(P=0.36),见表 2。
表 2 围手术期GC方案化疗后血液学不良反应(n(%))Table 2 Hematological toxicity of perioperative gemcitabine plus cisplatin regimen (n(%))
2.4 新辅助化疗后的临床及病理缓解率
接受新辅助化疗患者的临床缓解率及病理缓解率见表 3。其中临床完全缓解率(complete response, CR)+部分缓解率(partial response, PR)为68%(15/22),临床完全缓解率CR为45%(10/22)。有1例患者在接受两周期新辅助化疗后疾病进展而判定为疾病进展(progression disease, PD),随后终止化疗并立即接受了挽救性全膀胱切除手术。患者接受新辅助化疗后的病理完全缓解率(pT0)和降期率(< pT2)分别为36%(8/22)和64%(14/22)。所有达到病理完全缓解pT0的患者中均没有出现疾病复发,见图 2。其中在中位随访时间上,pT0和non-pT0组的RFS分别为100%和50%(P=0.012),差异有统计学意义。此外,接受辅助化疗的患者中没有1例达到pT0。
表 3 新辅助化疗患者的临床及病理缓解率(N=22)Table 3 Clinical and pathological outcomes of neoadjuvant chemotherapy patients (N=22)
2.5 两组治疗方案中淋巴结阳性患者统计
术后病理标本分析,在新辅助化疗和辅助化疗组中分别发现了6例和5例盆腔淋巴结阳性的患者,差异无统计学意义(27% vs. 31%, P=0.46)。
3 讨论
围手术期化疗,尤其是新辅助化疗可以显著提高肌层浸润性膀胱癌患者的生存期[8]。基于已有的高级别循证医学证据,新辅助化疗已经越来越多地得到认可并在各医学中心广泛开展[9-12]。几乎所有的临床研究均使用了以铂类为基础的化疗方案,如MAVC(甲氨蝶呤、长春碱、多柔比星和顺铂)方案,我们使用了同样是指南一线推荐的GC(吉西他滨,顺铂)方案[2, 6, 13-14]。遗憾的是,目前尚缺乏大规模的GC方案在肌层浸润性膀胱癌中的随机对照临床研究治疗效果[15]。尽管如此,在国内各大医学中心均已常规应用GC方案治疗肌层浸润性膀胱癌[11]。
本研究的目的是比较GC方案新辅助和辅助化疗的疗效差别。结果显示两组患者在接受围手术期化疗及手术治疗后的RFS差异无统计学意义。我们推测首先两组患者使用的化疗药物疗效相同,其次GC方案是指南认可的一线化疗方案。同样,与以往的回顾性研究结果类似,新辅助和辅助化疗的疗效没有差别[9, 12, 15]。当然,这些研究中使用的化疗方案各不相同,GC方案只占35%[9]。
GC方案和MVAC方案均被指南推荐为一线化疗方案,本研究采用GC方案是因为该方案的不良反应更小、耐受性好而且疗效相同[6, 16]。患者接受度高是保证围手术期化疗顺利完成的重要因素。本研究中,仅有一例患者因为疾病进展而终止了新辅助化疗,同时所有患者的血液学不良反应与以往的报道[17]基本相同。表现出了GC方案良好的耐受性及较小的不良反应。
pCR概念的引入是为了更好的评价新辅助化疗的疗效,与主要研究终点RFS一样,用来分析两组间的生存差异。根据西南肿瘤学组8710研究的结论,达到pT0患者的平均总生存期为13.6年[11]。本研究中,患者在接受新辅助化疗后的病理完全缓解率(pT0)和降期率(< pT2)分别为36%(8/22)和64%(14/22),所有达到pT0的患者均没有出现肿瘤复发。这说明pCR是一个理想的研究终点,尤其是当研究对象为评价新辅助化疗药物疗效时。
本研究的局限性表现在回顾性研究的内在缺陷,样本量相对较少、单中心研究、随访时间相对较短。此外,由于回顾性研究的本质决定了患者没有被随机分组,由此导致了化疗时机选择上的偏倚。因此,在随后的研究中,我们将设计前瞻性、随机、对照临床研究,并延长随访时间以填补本研究中存在的缺陷。
Competing interests: The authors declare that they have no competing interests.作者贡献:戴宇翃:研究实施、数据分析及论文写作谭茜敏、李一鸣、黄婷婷:参与数据收集和结果分析邱红:参与研究设计和构思邱萍:研究构思及设计、论文写作和修改 -
表 1 72例消化系统肿瘤患者的临床资料
Table 1 Clinical characteristics of 72 patients with digestive system malignancy

表 2 72例患者辅助治疗与一线治疗对比
Table 2 Adjuvant therapy versus first-line therapy on 72 patients

-
[1] 程建平, 赵晓琳, 李珍, 等. mXELIRI和mFOLFIRI方案联合西妥昔单抗一线治疗转移性左半结肠癌的临床观察[J]. 肿瘤防治研究, 2020, 47(7): 542-546. doi: 10.3971/j.issn.1000-8578.2020.19.1475 Cheng JP, Zhao XL, Li Z, et al. Clinical Observation of mXELIRI and mFOLFIRI Combined with Cetuximab in Firstline Treatment of Metastatic Left-side Colon Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(7): 542-546. doi: 10.3971/j.issn.1000-8578.2020.19.1475
[2] André T, Boni C, Mounedji-Boudiaf L, et al. Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer[J]. N Engl J Med, 2004, 350(23): 2343-2351. doi: 10.1056/NEJMoa032709
[3] de Gramont A, Figer A, Seymour M, et al. Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer[J]. J Clin Oncol, 2000, 18(16): 2938-2947. doi: 10.1200/JCO.2000.18.16.2938
[4] Bautista MA, Stevens WT, Chen CS, et al. Hypersensitivity reaction and acute immune-mediated thrombocytopenia from oxaliplatin: two case reports and a review of the literature[J]. J Hematol Oncol, 2010, 3: 12. doi: 10.1186/1756-8722-3-12
[5] Slade JH, Alattar ML, Fogelman DR, et al. Portal hypertension associated with oxaliplatin administration: clinical manifestations of hepatic sinusoidal injury[J]. Clin Colorectal Cancer, 2009, 8(4): 225-230. doi: 10.3816/CCC.2009.n.038
[6] Overman MJ, Maru DM, Charnsangavej C, et al. Oxaliplatin-mediated increase in spleen size as a biomarker for the development of hepatic sinusoidal injury[J]. J Clin Oncol, 2010, 28(15): 2549-2555. doi: 10.1200/JCO.2009.27.5701
[7] Jardim DL, Rodrigues CA, Novis YAS, et al. Oxaliplatin-related thrombocytopenia[J]. Ann Oncol, 2012, 23(8): 1937-1942. doi: 10.1093/annonc/mds074
[8] Rubbia-Brandt L, Audard V, Sartoretti P, et al. Severe hepatic sinusoidal obstruction associated with oxaliplatin-based chemotherapy in patients with metastatic colorectal cancer[J]. Ann Oncol, 2004, 15(3): 460-466. doi: 10.1093/annonc/mdh095
[9] Puente A, Fortea JI, Del Pozo C, et al. Porto-Sinusoidal Vascular Disease Associated to Oxaliplatin: An Entity to Think about It[J]. Cells, 2019, 8(12): 1506. doi: 10.3390/cells8121506
[10] Aloia T, Sebagh M, Plasse M, et al. Liver histology and surgical outcomes after preoperative chemotherapy with fluorouracil plus oxaliplatin in colorectal cancer liver metastases[J]. J Clin Oncol, 2006, 24(31): 4983-4990. doi: 10.1200/JCO.2006.05.8156
[11] 杨锭洪, 孟凡军, 林长裕. 口服双环醇对奥沙利铂联合卡培他滨方案治疗胃癌患者引起肝损伤的防治研究[J]. 实用癌症杂志, 2014, 29(6): 660-662. doi: 10.3969/j.issn.1001-5930.2014.06.016 Yang DH, Meng FJ, Lin CY. Study of prevention of bicclol for hepatic damage caused by Oxaliplatin plus capecitabine for gastric cancer[J]. Shi Yong Ai Zheng Za Zhi, 2014, 29(6): 660-662. doi: 10.3969/j.issn.1001-5930.2014.06.016
[12] 徐盟, 费倩, 孟潇, 等. 多烯磷脂酰胆碱对奥沙利铂联合氟尿嘧啶所致荷瘤裸鼠肝损伤的保护作用[J]. 中国医科大学学报, 2017, 46(6): 544-547. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGYK201706015.htm Xu M, Fei Q, Meng X, et al. Effects of Polyene Phosphatidylcholine on Hepatic Injury of Tumor?bearing Nude Mice Induced by Oxaliplatin and 5?fluorouracil Chemotherapy[J]. Zhongguo Yi Ke Da Xue Xue Bao, 2017, 46(6): 544-547. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGYK201706015.htm
[13] Zou X, Wang Y, Peng C, et al. Magnesium isoglycyrrhizinate has hepatoprotective effects in an oxaliplatininduced model of liver injury[J]. Int J Mol Med, 2018, 42(4): 2020-2030. http://www.ncbi.nlm.nih.gov/pubmed/30066834
[14] Robinson SM, Mann J, Vasilaki A, et al. Pathogenesis of FOLFOX induced sinusoidal obstruction syndrome in a murine chemotherapy model[J]. J Hepatol, 2013, 59(2): 318-326. doi: 10.1016/j.jhep.2013.04.014
[15] Ribero D, Wang H, Donadon M, et al. Bevacizumab improves pathologic response and protects against hepatic injury in patients treated with oxaliplatin-based chemotherapy for colorectal liver metastases[J]. Cancer, 2007, 110(12): 2761-2767. doi: 10.1002/cncr.23099
[16] Overman MJ, Ferrarotto R, Raghav K, et al. The Addition of Bevacizumab to Oxaliplatin-Based Chemotherapy: Impact Upon Hepatic Sinusoidal Injury and Thrombocytopenia[J]. J Natl Cancer Inst, 2018, 110(8): 888-894. doi: 10.1093/jnci/djx288
[17] Klinger M, Eipeldauer S, Hacker S, et al. Bevacizumab protects against sinusoidal obstruction syndrome and does not increase response rate in neoadjuvant XELOX/FOLFOX therapy of colorectal cancer liver metastases[J]. Eur J Surg Oncol, 2009, 35(5): 515-520. doi: 10.1016/j.ejso.2008.12.013
[18] Rubbia-Brandt L, Lauwers GY, Wang H, et al. Sinusoidal obstruction syndrome and nodular regenerative hyperplasia are frequent oxaliplatin-associated liver lesions and partially prevented by bevacizumab in patients with hepatic colorectal metastasis[J]. Histopathology, 2010, 56(4): 430-439. doi: 10.1111/j.1365-2559.2010.03511.x
[19] Iwai T, Yamada T, Koizumi M, et al. Oxaliplatin-induced increase in splenic volume; irreversible change after adjuvant FOLFOX[J]. J Surg Oncol, 2017, 116(7): 947-953. doi: 10.1002/jso.24756
[20] Kim MJ, Han SW, Lee DW, et al. Splenomegaly and Its Associations with Genetic Polymorphisms and Treatment Outcome in Colorectal Cancer Patients Treated with Adjuvant FOLFOX[J]. Cancer Res Treat, 2016, 48(3): 990-997. doi: 10.4143/crt.2015.296
[21] Bezerra AS, D'Ippolito G, Faintuch S, et al. Determination of splenomegaly by CT: is there a place for a single measurement?[J]. AJR Am J Roentgenol, 2005, 184(5): 1510-1513. doi: 10.2214/ajr.184.5.01841510
[22] Rezai P, Tochetto SM, Galizia MS, et al. Splenic volume model constructed from standardized one-dimensional MDCT measurements[J]. AJR Am J Roentgenol, 2011, 196(2): 367-372. doi: 10.2214/AJR.10.4453
[23] Yetter EM, Acosta KB, Olson MC, et al. Estimating splenic volume: sonographic measurements correlated with helical CT determination[J]. AJR Am J Roentgenol, 2003, 181(6): 1615-1620. doi: 10.2214/ajr.181.6.1811615
[24] 王萱, 薛华丹, 刘炜, 等. 应用64层螺旋CT探讨脾体积的简易估测方法[J]. 临床放射学杂志, 2009, 28(4): 560-563. https://www.cnki.com.cn/Article/CJFDTOTAL-LCFS200904043.htm Wang X, Xue HD, Liu W, et al. A simple way to estimante splenic volume from CT images with 64-slice spiral CT[J]. Lin Chuang Fang She Xue Za Zhi, 2009, 28(4): 560-563. https://www.cnki.com.cn/Article/CJFDTOTAL-LCFS200904043.htm



 下载:
下载: