Clinical Features and Prognosis of 60 Cases of HIV-negative Plasmablastic Lymphomas Patients
-
摘要:目的
探讨HIV阴性浆母细胞淋巴瘤(PBL)的临床特征及预后。
方法搜集1997年1月1日—2020年3月30日本院及其他文献报道的HIV阴性PBL病例,使用Logistic回归分析、Kaplan-Meier法和Cox回归分析对筛选的临床特征、分子病理、治疗以及预后相对完整的病案进行分析。
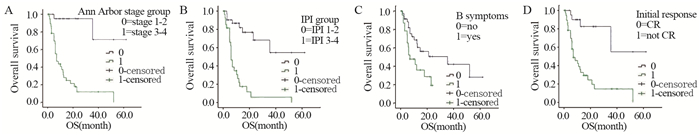
结果共收集60例患者,平均年龄为53.06±14.36岁,多数患者有较高的Ann Arbor分期和Ki-67表达,OS为13.48±13.21月,Kaplan-Meier分析显示Ann Arbor分期、IPI指数(3~5)、B症状、初始治疗能否达到CR均与生存显著相关。Cox回归分析显示Ann Arbor分期和IPI指数是影响患者生存的独立预后因素。
结论HIV阴性浆母细胞淋巴瘤发病多在中老年段,诊断时分期偏晚,肿瘤增殖较快,治疗以联合化疗为主,但治疗反应和OS的异质性较大,多数预后不良,疾病分期和IPI指数与预后显著相关。
Abstract:ObjectiveTo investigate the clinical features and prognosis of HIV-negative plasmablastic lymphoma (PBL) patients.
MethodsWe collected HIV-negative PBL cases reported in our hospital and other literatures from online databases from January 1, 1997 to March 30, 2020. The data of clinical features, molecular pathology, treatment and prognosis were summarized and analyzed.
ResultsWe included 60 PBL patients, average age was 53.06±14.36 years, and most of them had relatively high Ann Arbor stage and Ki-67 expression. The average OS was 13.48±13.21 m. Kaplan-Meier curve revealed Ann Arbor stage, IPI index (3-5), B symptoms and CR in initial treatment were significantly related with patients' survival. Cox regression analysis indicated that the Ann Arbor stage and IPI index were the independent prognostic factors for patients' survival. Conclusion HIV-negative PBL mostly occurs in the middle-age and elderly patients, with advanced diagnosis stage and rapid tumor proliferation.
Combinationchemotherapy is the main treatment, while the therapeutic response and OS might be heterogeneous, the prognosis of most patients would be poor. The stage and IPI index are significantly related to the prognosis.
-
Key words:
- Lymphoma /
- Clinical features /
- Treatment /
- Prognosis
-
0 引言
乳腺癌作为女性常见恶性肿瘤之一,其良恶性鉴别诊断已成为当下研究热点。利用动态增强MRI(dynamic contrast-enhanced MRI, DCE-MRI)定量分析等研究已广泛开展。近几年,影像组学正受到越来越多学者的关注,其中直方图及纹理分析作为一种重要的研究方法,在临床工作中的作用及科研价值也越来越大。本试验旨在利用直方图及纹理特征分析在T2反转恢复压脂(turbo inversion recovery magnitude, Tirm)序列上鉴别诊断乳腺良恶性病变。
1 资料与方法
1.1 研究对象
回顾性分析徐州市肿瘤医院2016年2月—2018年1月间经病理确诊的术前行MRI扫描的乳腺病变患者100例(年龄26~79岁,中位年龄52岁,良性:恶性=47:53)。病变组纳入标准:(1)良性病变组包括囊肿、纤维腺瘤、腺病;恶性病变组包括黏液癌、浸润癌及导管内癌;(2)全部病灶最大截面直径 > 1 cm;(3)检查前未经手术、放疗、化疗及靶向药物治疗者;(4)图像无明显运动伪影。排除标准:(1)年龄在25岁以下或大于80岁的患者;(2)怀孕、哺乳期妇女;(3)患有严重心、肝、肾等器质性病变;(4)MR检查禁忌证。本研究已通过徐州市肿瘤医院伦理委员会审查,所有患者检查前均已签署知情同意书。
1.2 MRI扫描方法
使用Siemens MAGNETOM Avanto 1.5T超导磁共振仪,8通道乳腺专用矩阵线圈进行扫描,患者取俯卧位。将双乳自然悬垂于乳腺线圈内;并嘱患者在整个检查过程中保持平静呼吸。Tirm序列具体参数:TR 3700 ms,TE 85 ms,TI 160 ms,层厚3.0 mm,矩阵256×256;FOV 220 mm×220 mm,距离因子10%,层数13,平均次数2,总扫描时间为174 s。
1.3 病理结果
所有患者均于检查后3天内手术。手术切除病变标本后,经中性福尔马林液固定,石蜡包埋、HE染色(部分实验结果见图 1~3)。经病理会诊后得到病理诊断结论。
1.4 MRI图像分析
将得到的所有MRI图像经工作站处理并导入血流动力学定量分析软件(GE Omni-Kinetics Version V2.20软件)进行分析,纹理分析基于灰度共生矩阵(gray level co-occurrence matrix, GLCM),得到能量值、熵值、惯量值、逆差矩及自相关性、群显著性;直方图特征参数包括平均值、偏度、峰度。每个病灶选取病灶最大截面层面及邻近上下各一层共3层图像,建立3D-ROI数据。
1.5 统计学方法
应用SPSS25.0统计学软件对数据进行分析。正态分布数据描述以频数、均数±标准差表示,非正态分布以中位数+四分位间距表示。良恶性组间各参数比较采用两独立样本的非参数检验方法;此外,构建受试者工作特征曲线(receiver operating characteristic curve, ROC)并计算曲线下面积,根据约登指数结合临床实际评价乳腺良、恶性组间的差异,确定诊断临界值。所有统计分析均选取α=0.05作为假设检验水准进行双侧检验。
2 结果
2.1 形态学特征
100例病灶中,良性病变中:纤维腺瘤25例、囊肿17例、腺病5例;45例病变境界清晰、2例腺病表现为边缘及境界欠清晰。恶性病变中:浸润性癌27例、导管内癌8例、黏液癌18例;53例均表现为边缘模糊,境界不清晰,并见毛刺形成。在良性组、恶性组中,能量值、熵值、惯量值、自相关性、逆差距、群显著性、平均值、偏度及峰度的中位数、四分位间距以及两组间的Z值、P值见表 1。
表 1 直方图参数及纹理参数在良恶性组间比较Table 1 Comparison of histogram parameters and texture parameters between benign and malignant groups
2.2 自相关性、群显著性、平均值及峰度值分别鉴别乳腺良恶性病变的诊断价值
ROC分析结果显示:自相关性的最佳诊断界值为4.935×10-5,此时敏感度为92.45%,特异性为55.32%,约登指数为0.478。峰度值的最佳诊断界值为3.000,此时敏感度为75.47%,特异性为70.21%,约登指数为0.457。群显著性的最佳诊断界值为1.063×1010,此时敏感度为77.36%,特异性为72.34%,约登指数为0.497。平均值的最佳诊断界值为1.753×102,此时敏感度为58.49%,特异性为100%,约登指数为0.585,见图 4、表 2。
表 2 自相关性、群显著性及平均值、峰度值的ROC曲线下面积Table 2 Area under the curve(AUC) of correlation, cluster prominence, mean value and kurtosis
2.3 联合自相关性、峰度值、群显著性及平均值4个指标鉴别乳腺良恶性病变
ROC分析结果显示:将自相关性、峰度值、群显著性及平均值作为联合指标预测乳腺良恶性病变,则约登指数为0.629,敏感度为90.57%,特异性为72.34%,见图 5、表 3。
表 3 联合自相关性、群显著性及平均值、峰度值指标的ROC曲线下面积Table 3 AUC of combination of correlation, cluster prominence, mean value and kurtosis parameters
3 讨论
乳腺癌早期诊断、分期及疗效评估作为乳腺癌重要的研究方向,一直以来备受关注[1]。目前,利用直方图及纹理分析等方法对乳腺肿瘤鉴别诊断及疗效评估已成为影像组学研究的重要组成部分[2-4]。Ko等[5]已发现乳腺癌肿块异质性与乳腺癌MR图像纹理特征具有一定的相关性。国内亦有文献报道[6]运用DCE-MRI纹理分析对乳腺癌新辅助化疗的患者进行预测评价时发现,能量值、熵值、惯量值和自相关性对于乳腺癌新辅助化疗后早期疗效评估具有一定的价值。Prevos等[7]的研究也证实了这一点。近几年,DCE-MRI作为乳腺癌MRI研究的热点,其最大优势在于能够完整描述乳腺病变整体的血流动力学特点,因而也成为当前研究乳腺癌的主要方法[8]。然而乳腺病变患者在DCE-MRI图像采集过程中时间分辨率要求较高[9],Tirm序列能够作为其重要补充,我们认为其优势首先在于Tirm序列相较于DCE-MRI图像质量能够得到保证,且对于病变的细节显示较常规T1WI及T2WI好;其次,Tirm序列由于脂肪抑制技术的应用使富含脂肪成分的乳腺组织显示对比度较高,也在一定程度上提高了病变的检出率。然而尽管如此,Tirm序列也只是作为常规MRI扫描的一部分,因此提供的信息没有DCE-MRI丰富,这也成为本次研究的不足。在今后的研究中将不同序列进行比较从而评价哪一个参数的诊断价值更高也是重要的研究方向。同时纹理分析及直方图分析作为一种定量分析方法,能够更加准确描述病变的生理信息及血流动力学特征,从而对乳腺良恶性病变的术前鉴别诊断提供更多有价值的信息。张竹伟等[10]利用T2WI序列进行纹理分析得到了较为理想的结果。
本研究中,结合乳腺良恶性组数据特点我们可以推测对于自相关性及峰度值这两个指标采用较大的检验结果表示对乳腺癌有一定的阳性诊断价值:即当患者的自相关性及峰度值大于诊断临界值时更倾向于诊断乳腺癌;对群显著性和平均值小于诊断临界值时更倾向于诊断为乳腺癌。此外,本组病例中能量值、熵值、惯量值及偏度值在乳腺良恶性病变间的差异无统计学意义,说明这四个参数对乳腺良恶性病变Tirm序列上的鉴别无明显提示作用。推测可能原因为乳腺良性病变中纤维腺瘤、腺病与乳腺癌在Tirm序列上的表现存在部分重叠。本研究中乳腺黏液癌与浸润性导管癌的直方图分布不一致,纤维腺瘤直方图形态与黏液癌的直方图形态也存在一定的差别,说明直方图分析在鉴别乳腺良恶性病变及乳腺癌不同病理类型中可能具有一定的价值。类似的结果在冯红梅等[11]研究中也得到了验证。本研究中,乳腺良恶性病变的偏度均为负,其中乳腺癌的偏度较小,可能与乳腺癌中存在微小钙化有关,这与Ko等[5]在研究中发现的熵值在T2WI及增强的T1WI上诊断浸润性乳腺癌具有一定的价值也是一致的。除此之外,我们发现2例腺病病灶境界不清晰,这可能与腺病引起腺体变形、纤维化,并且在MRI上表现与浸润性癌类似有关。
本研究数据经后处理软件分析可得到57个参数,我们仅选取部分较常用参数进行比较分析,且该研究中尚未对纹理特征及直方图参数进行选择以排除对ROI选择敏感的参数,这将在以后的研究中逐步完善。再者,本研究的诊断阈值仍需要大样本量数据的验证。此外,该研究仅对Tirm序列上乳腺良恶性病变的直方图及纹理的特征进行分析,未做其他序列的对照研究,故也具有一定的局限性。综上所述,常规MRI图像纹理分析可为鉴别乳腺良恶性病变提供可靠的信息,作为乳腺DCE-MRI序列的补充,Tirm序列对于鉴别乳腺良恶性病变的纹理特征也能够提供有价值的信息。
Competing interests: The authors declare that they have no competing interests.作者贡献许文婧:统计分析及论文撰写王佩:网络数据搜索与整理马玥诗:临床数据检索与整理,统计分析高丽萍:论文指导与修改 -
表 1 HIV阴性浆母细胞淋巴瘤患者的临床特征
Table 1 Clinical characteristics of HIV-negative plasmablastic lymphoma (PBL) patients

表 2 HIV阴性浆母细胞淋巴瘤患者的分子病理特征
Table 2 Molecular pathological characteristics of HIV-negative PBL patients

表 3 HIV阴性浆母细胞淋巴瘤患者的治疗策略、治疗反应及预后(N=60)
Table 3 Treatment strategies, response and prognosis of HIV-negative PBL patients (N=60)

表 4 HIV阴性PBL患者的临床特征与初次治疗反应
Table 4 Clinical characteristics and initial treatment response of HIV-negative PBL patients

表 5 HIV阴性PBL患者的临床特征与生存的关系
Table 5 Clinical characteristics and survival of HIV-negative PBL patients

-
[1] Swerdlow SH, Campo E, Pileri SA, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms[J]. Blood, 2016, 127(20): 2375-2390. doi: 10.1182/blood-2016-01-643569
[2] Castillo JJ, Bibas M, Miranda RN. The biology and treatment of plasmablastic lymphoma[J]. Blood, 2015, 125(15): 2323-2330. doi: 10.1182/blood-2014-10-567479
[3] Reardon S. Infections reveal inequality between the sexes[J]. Nature, 2016, 54(7608): 447.
[4] Liu M, Liu B, Liu B, et al. Human immunodeficiency virus-negative plasmablastic lymphoma: a comprehensive analysis of 114 cases[J]. Oncol Rep, 2015, 33(4): 1615-1620. doi: 10.3892/or.2015.3808
[5] 蓝三春, 谢婧, 朱搏宇, 等. 乙型肝炎病毒相关浆母细胞淋巴瘤1例并文献复习[J]. 军事医学, 2018, 42(1): 77-78, 80. https://www.cnki.com.cn/Article/CJFDTOTAL-JSYX201801031.htm Lan SC, Xie J, Zhu BY, et al. A case of hepatitis B virus-related plasmablastic lymphoma and literature review[J]. Jun Shi Yi Xue, 2018, 42(1): 77-78, 80. https://www.cnki.com.cn/Article/CJFDTOTAL-JSYX201801031.htm
[6] Sarode SC, Sarode GS, Patil A. Plasmablastic lymphoma of the oral cavity: a review[J]. Oral Oncol, 2010, 46(3): 146-153. doi: 10.1016/j.oraloncology.2009.12.009
[7] Lopez A, Abrisqueta P. Plasmablastic lymphoma: current perspectives[J]. Blood Lymphat Cancer, 2018, 8: 63-70. http://www.researchgate.net/publication/328072487_Plasmablastic_lymphoma_current_perspectives/download
[8] Bhatt R, Desai DS. Plasmablastic Lymphoma[M/OL]. StatPearls Publishing[2020-8-24]. https://www.ncbi.nlm.nih.gov/books/NBK532975/
[9] Castillo JJ, Winer ES, Stachurski D, et al. HIV-negative plasmablastic lymphoma: not in the mouth[J]. Clin Lymphoma Myeloma Leuk, 2011, 11(2): 185-189. doi: 10.1016/j.clml.2011.03.008
[10] Castillo JJ, Winer ES, Stachurski D, et al. Clinical and pathological differences between human immunodeficiency virus-positive and human immunodeficiency virus-negative patients with plasmablastic lymphoma[J]. Leuk Lymphoma, 2010, 51(11): 2047-2053. doi: 10.3109/10428194.2010.516040
[11] Akce M, Chang E, Haeri M, et al. Bortezomib, Ifosfamide, Carboplatin, and Etoposide in a Patient with HIV-Negative Relapsed Plasmablastic Lymphoma[J]. Case Rep Hematol, 2016, 2016: 3598547. http://www.ncbi.nlm.nih.gov/pubmed/27957358
[12] 范舟, 李基炜, 易平勇, 等. 5例浆母细胞淋巴瘤临床病例分析和文献回顾[J]. 肿瘤药学, 2018, 8(1): 124-128. doi: 10.3969/j.issn.2095-1264.2018.01.29 Fan Z, Li JW, Yi PY, et al. Case Report on 5 Plasmablastic Lymphoma Patients and Literature Review by Retrospective Analysis[J]. Zhong Liu Yao Xue, 2018, 8(1): 124-128. doi: 10.3969/j.issn.2095-1264.2018.01.29
[13] Yan M, Dong Z, Zhao F, et al. CD20-positive plasmablastic lymphoma with excellent response to bortezomib combined with rituximab[J]. Eur J Haematol, 2014, 93(1): 77-80. doi: 10.1111/ejh.12286
[14] Holderness BM, Malhotra S, Levy NB, et al. Brentuximab vedotin demonstrates activity in a patient with plasmablastic lymphoma arising from a background of chronic lymphocytic leukemia[J]. J Clin Oncol, 2013, 31(12): e197-199. doi: 10.1200/JCO.2012.46.9593
[15] Pretscher D, Kalisch A, Wilhelm M, et al. Refractory plasmablastic lymphoma-a review of treatment options beyond standard therapy[J]. Ann Hematol, 2017, 96(6): 967-970. doi: 10.1007/s00277-016-2904-7
[16] Mine S, Hishima T, Suganuma A, et al. Interleukin-6-dependent growth in a newly established plasmablastic lymphoma cell line and its therapeutic targets[J]. Sci Rep, 2017, 7(1): 10188. doi: 10.1038/s41598-017-10684-5
[17] Koenig G, Stevens TM, Peker D. Plasmablastic microlymphoma arising in human herpesvirus-8-associated multicentric Castleman disease in a human immunodeficiency virus-seronegative patient with clinical response to anti-interleukin-6 therapy[J]. Histopathology, 2015, 67(6): 930-932. doi: 10.1111/his.12718
[18] Yanamandra U, Sahu KK, Jain N, et al. Plasmablastic lymphoma: successful management with CHOP and lenalidomide in resource constraint settings[J]. Ann Hematol, 2016, 95(10): 1715-1717. doi: 10.1007/s00277-016-2732-9
[19] Laurent C, Fabiani B, Do C, et al. Immune-checkpoint expression in Epstein-Barr virus positive and negative plasmablastic lymphoma: a clinical and pathological study in 82 patients[J]. Haematologica, 2016, 101(8): 976-984. doi: 10.3324/haematol.2016.141978
[20] Cattaneo C, Finel H, McQuaker G, et al. Autologous hematopoietic stem cell transplantation for plasmablastic lymphoma: the European Society for Blood and Marrow Transplantation experience[J]. Biol Blood Marrow Transplant, 2015, 21(6): 1146-1147. doi: 10.1016/j.bbmt.2015.03.008
[21] Elyamany G, Al Mussaed E, Alzahrani AM. Plasmablastic Lymphoma: A Review of Current Knowledge and Future Directions[J]. Adv Hematol, 2015, 2015: 315289. http://www.ncbi.nlm.nih.gov/pubmed/27110244
-
期刊类型引用(18)
1. 常金明,丁航,余银保,郭爽. LMR、PLR及术前临床特征预测非小细胞肺癌患者的预后价值. 河南外科学杂志. 2025(01): 9-13 .  百度学术
百度学术
2. 周泽光,徐伟,陈一峰,党博文,刘成倍. 新辅助化疗前后SII指数变化对局部进展期前列腺癌预后的评估价值. 国际泌尿系统杂志. 2024(01): 33-37 .  百度学术
百度学术
3. 陈新于,韩冬,李宇峰,薛东明,王峦,潘家俊,严文俊. 老年早期非小细胞肺癌采用经皮微波凝固疗法后预后不良的影响因素分析. 中国医药导报. 2024(02): 112-115 .  百度学术
百度学术
4. 汪锋平,吴芬芝,杨婷,郑晓燕. CD_4~+/CD_8~+比值与中性粒细胞CD_(64)在非小细胞肺癌中的诊断价值. 浙江临床医学. 2024(05): 755-757 .  百度学术
百度学术
5. 杨娟,秦小涵,郭雯雯,丁云鹤,吴小进. 放疗前SII、PNI和LDH对放射性肺炎的预测价值. 徐州医科大学学报. 2024(04): 279-284 .  百度学术
百度学术
6. 邵博. 系统免疫炎症指数、营养控制状态评分在评估早期胃癌患者腹腔镜手术预后中的应用价值. 中国卫生工程学. 2024(04): 499-501+504 .  百度学术
百度学术
7. 杨贺乐,尹家海,邓小杰. C反应蛋白/白蛋白比值、系统性免疫炎症指数对艾滋病机会性感染的预测价值. 中国医师进修杂志. 2023(10): 948-953 .  百度学术
百度学术
8. 齐莹莹,林琳. 清蛋白-胆红素指数和系统性免疫炎症指数与肺癌病理参数及预后的关系. 临床检验杂志. 2023(09): 667-673 .  百度学术
百度学术
9. 邹谧,潘静,周平,陈巧. 炎症指标对冠状动脉狭窄程度的预测价值. 岭南心血管病杂志. 2023(04): 349-353 .  百度学术
百度学术
10. 麻玲霞,黄遐,徐永荣,李燕. 预后营养指数和系统免疫炎症指数与肾透明细胞癌患者预后的关系. 广西医学. 2023(19): 2325-2330 .  百度学术
百度学术
11. 石明伟,王俊康,王静. 系统免疫炎症营养指数对接受免疫检查点抑制剂治疗的非小细胞肺癌患者临床疗效及预后的评估价值研究. 解放军医学院学报. 2023(12): 1372-1378+1383 .  百度学术
百度学术
12. 朱祎曜,何丹,吴小波. 外科治疗早期老年非小细胞肺癌患者的预后. 中国老年学杂志. 2022(09): 2103-2105 .  百度学术
百度学术
13. 轩晓倩,赵君慧,杨小茜. 炎性指标在非小细胞肺癌患者预后中的临床意义. 临床荟萃. 2022(07): 663-667 .  百度学术
百度学术
14. 杨荆,樊文星,毕丹青. MHD患者院内感染的病原学特征及SII、PLR、IL-33检测对感染的预测. 中国病原生物学杂志. 2022(09): 1090-1094 .  百度学术
百度学术
15. 黄林瑶,江天,严建新. 系统免疫炎症指数在类风湿性关节炎患者中的临床应用价值. 中国卫生检验杂志. 2022(19): 2382-2385 .  百度学术
百度学术
16. 刘洪波,肖红霞,田玉廷. PSA和NTx及D-D联合系统免疫炎症指数对前列腺癌骨转移的诊断价值. 中国卫生工程学. 2022(06): 1035-1037+1040 .  百度学术
百度学术
17. 张小磊,江晓晖,吴金东. 系统免疫炎症指数和血小板/淋巴细胞比值与胃癌患者术后预后的关系. 现代医学与健康研究电子杂志. 2022(24): 24-28 .  百度学术
百度学术
18. 肖辉辉. 血清细胞因子在肺癌发生发展中的研究现状. 现代诊断与治疗. 2022(17): 2554-2556 .  百度学术
百度学术
其他类型引用(6)




 下载:
下载: