Risk Factors of Non-curative Resection in Superficial Esophageal Cancer After Endoscopic Submucosal Dissection and Long-term Survival Analysis
-
摘要:目的
探讨表浅型食管癌(SEC)经内镜黏膜下剥离术(ESD)后导致非治愈性切除的危险因素及其预后情况。
方法回顾性分析214处SEC病变(207例患者)行食管ESD治疗的情况。共随访15~102月,中位随访时间48月。
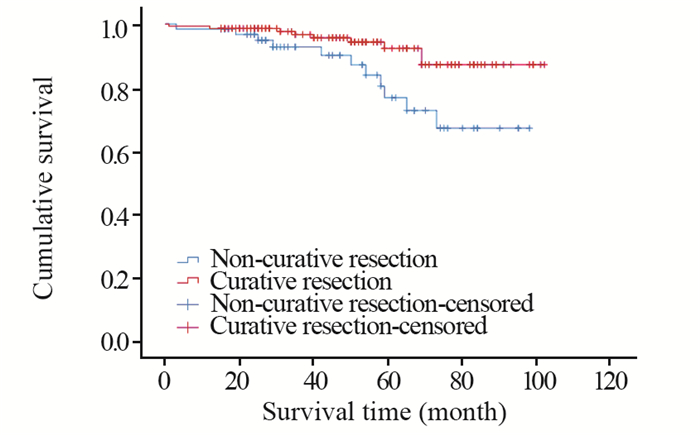
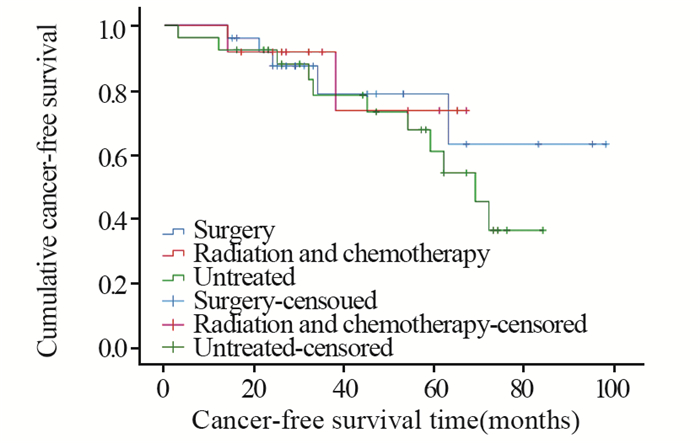
结果所有病例中,整块切除率89.25%(191/214),完全切除率80.84 %(173/214),治愈性切除率70.09%(150/214),非治愈取切除率29.91%(64/214),切除标本最大长径110 mm。单因素分析结果显示,年龄、性别、肿瘤体积、术时病灶抬举情况和手术时间与术后导致非治愈性切除相关(P < 0.05)。多因素分析结果显示:女性、肿瘤长径≥50 mm、术时病灶抬举欠佳是术后导致非治愈性切除的危险因素。在非治愈切除组中,ESD后无任何相关治疗的患者与接受开放手术的、放化疗的患者的无癌生存期、生存期差异均无统计学意义。
结论对于一般状况差的、不愿行外科手术及放化疗的非治愈性切除患者,定期内镜检查亦不失为一个可能的选择。
-
关键词:
- 食管癌 /
- 内镜黏膜下剥离术(ESD) /
- 非治愈性切除 /
- 危险因素 /
- 生存分析
Abstract:ObjectiveTo identify risk factors of non-curative resection in superficial esophageal cancer (SEC) after endoscopic submucosal dissection and to evaluate the prognosis.
MethodsWe retrospectively analyzed the data of 207 SEC patients who received ESD. The median follow-up was 48 months.
ResultsThe en bloc resection rate was 89.25% (191/214), the complete resection rate was 80.84 % (173/214), the curative resection rate was 70.09% (150/214) and the non-curative resection rate was 29.91% (64/214). The maximum long diameter of specimen was 110 mm. Age, gender, tumor size, lesions performance during surgery and operation time were associated with the non-curative resection (P < 0.05). Female, lesion diameter≥50mm and poorly performed lesions were identified as significant risk factors for non-curative resection. In the non-curative resection group, there was no difference in cancer-free survival and survival between patients who had no additional treatmeat after ESD and those who underwent surgery or radiotherapy.
ConclusionFor patients with poor general condition who are not willing to undergo surgery or chemoradiotherapy, regular endoscopy seems to be an option.
-
0 引言
中国胃癌患者平均死亡率高达20/10万,占恶性肿瘤的第一位[1]。究其原因可能与原发肿瘤致病基因突变、药物的敏感度反应、耐药机制多样性等异质性相关[2],为此,探求早期预测生物学进展标志物成为研究热点。本研究应用ELISA法、多重RNA/DNA原位分析等方法,对ⅢB期胃癌术后患者辅助化疗后随访期内进行动态检测外周血癌胚抗原(carcino-embryonic antigen, CEA)、p21活化激酶5(p21-activated kinase 5, PAK5)、循环肿瘤细胞(circulating tumor cells, CTC)以及同时期CT检查,以期达到早期生物学预测复发转移的目的。
1 资料与方法
1.1 临床资料
收集2015年1月—2017年12月河北医科大学第四医院肿瘤内科胃癌根治术后完全缓解的患者150例。入组条件:术前晨空腹肘部外周静脉血CEA值超过正常值的5倍、术后病理诊断为胃腺癌ⅢB期(T4bN1-2M0、T4aN2M0、T3N3M0)(按照AJCC第七版)。治疗方案以奥沙利铂或紫杉醇为主的方案辅助化疗6周期,其中多西他赛为主方案72例,奥沙利铂为主方案78例。后续定期随访,每3月进行CEA检测和影像学评估。
分组标准:随访期内血浆CEA检测正常患者设为对照组,共50例。随访期内第一次CEA升高超过正常值5倍患者为实验组,共100例,同时按CEA水平增高不同情况,再分为两组:CEA进行性增高组(实验A组)和无规律增高组(实验B组)。
入组患者基线情况:入组时患者整体分期、化疗周期数、血浆癌胚抗原CEA、PAK5、CTC和影像学检查肿瘤病情评估差异均无统计学意义(P > 0.05)。所有患者按照住院或门诊评估的方式进行随访,随访截至2017年12月31日。
1.2 检测方法和频次
应用ELISA、多重RNA/DNA原位分析等方法,分别采集两组患者不同时刻的晨空腹肘部外周静脉血,检测血浆中癌胚抗原CEA、PAK5和CTC的水平。CEA由我院生化室完成检测。PAK5和CTC均由广州益善公司协助完成检测。
动态检测时间点的选择:T0:术前癌胚抗原超过正常值5倍; T1:术后辅助化疗6周期后; T2:CEA首次超过正常值5倍,本研究将其确定为生物学进展时间; T3:首次CT证实进展和(或)无影像学进展的患者随访截止时间。实验组动态检测三次(T1、T2、T3),对照组动态检测两次(T1、T3)。
1.3 各指标阳性判定标准
癌胚抗原CEA阳性标准:CEA的正常值为 < 5 ng/ml。超过正常值的5倍为生物学进展阳性。CTC阳性标准:CTC检测分为上皮型、混合型、间质型,其中上皮型认定为良性,混合型认定为生物学进展,间质型认定为恶性复发转移,即为影像学进展,见图 1。PAK5检测标准:根据表达强度分为无表达、低表达、中表达、高表达。本研究判定标准:无表达和低表达为阴性,中表达和高表达为阳性,其中中表达/总细胞数的比率判定为生物学进展; 高表达/总细胞数的比率判定为影像进展,见图 2。
2 结果
2.1 CEA与胃癌术后疾病进展关系
截至随访时间,对照组50例患者中均未见CEA增高,影像学未见明确病灶。实验两组中,按照生物学进展时间(T2):实验A组为3~24月,中位时间13月。实验B组为4~32月,中位时间22月。按照影像进展时间(T3):实验A组39例(78%)进展,出现时间为5~8月,中位时间为6.2月。实验B组12例(24%)进展,出现时间为4~15月,中位时间为10.6月。实验A组较B组更能提示复发转移。
2.2 CTC变化情况与胃癌术后疾病进展关系
T2时,实验A组混合型和间质型之和/总单细胞数比值大于30%,提示生物学进展; 间质型细胞数≥1在两实验组之间有差异,但无统计学意义。T3时,实验A组混合型和间质型之和/总单细胞数比值大于50%,提示影像学进展。间质型细胞数≥1在两实验组之间有差异,但病例数尚少,未行统计学分析,见表 1。
表 1 实验组CTC变化与ⅢB期胃癌术后患者肿瘤进展的关系Table 1 Relation between CTC change and tumor progression in patients with stage ⅢB gastric cancer after operation
2.3 PAK5变化与胃癌术后疾病进展关系
T2时,无表达、低表达、中表达数据没有偏移,两组间高表达数据有偏移; T3无表达、低表达数据没有偏移,两组间中、高表达数据有偏移。因为病例数尚少,未行统计学分析,见表 2。
表 2 PAK5表达与ⅢB期胃癌术后患者复发进展的关系Table 2 Relation between PAK5 expression and tumor progression in patients with stage ⅢB gastric cancer after operation
对明确影像学进展的51例患者的CTC细胞进行PAK5检测,中表达数值为13.6%~83%,高表达数值为37.8%~100%。
2.4 实验组CEA、PAK5、CTC三者阳性表达一致性
由于实验B组仅有12例(24%)患者影像学提示进展,病例数尚少,未行统计学分析。对实验A组39例影像学提示进展患者进行比较,T2时,CTC和PAK5、CEA判定的一致性为82%。T3时,和PAK5、CEA判定的一致性为94%。
3 讨论
中国ⅢB期胃癌术后5年生存率仅为15%~35%,究其原因在于部分患者术后即发生早期转移。临床上常常将癌胚抗原(CEA)作为ⅢB期胃癌术后随访复发转移的生物标志物[3]。本研究CEA进行性增高组(实验A组)有78%的患者肿瘤影像证实进展,有利于早期诊断复发转移。而CEA无规律增高组(实验B组)仅有24%提示肿瘤影像学进展,单指标检测存在假阳性,与文献报道CEA具有非特异性、易受炎性反应性疾病的干扰相一致。因此,提高预测指标的准确性成为临床研究的趋势,才能更好地避免给患者带来精神压力和过度治疗的可能性。
有研究报道CTC的间质型细胞具有恶性行为[4-6],但对于混合型的恶性度报道不一,实体瘤的异质性导致的胃癌CTC的阳性标准不同于乳腺癌,尚无明确共识。本研究数据表明间质型细胞数大于1可早期预测影像学进展。但对于混合型的恶性度报道不一,本研究考虑混合型细胞具有恶性变的趋势,疾病进展演变成间质型,其演变过程是从肿瘤生物学进展发展到影像学进展的过程,可以很好地预测影像学进展。本研究应用统计学分析(混合型+间质型)/总单细胞数比值大于30%可早期预测生物学进展可能; (混合型+间质型)/总单细胞数比值大于50%可早期预测影像学进展可能。由于混合型细胞中有良性细胞成分和恶性成分,因本研究例数尚少,目前尚无更好的方法区分生物学进展,待扩大样本数后进一步进行验证。
为了更好的推算混合型向间质型细胞的演化时间,本研究增加检测了一种上游癌基因P21活化激酶亚型PAK5,有学者对恶性肿瘤组织标本检测数据表明PAK5过度表达或突变激活,参与了部分恶性实体瘤发生、发展[7-14],但在胃癌中的研究较少[15-16]。本研究数据表明PAK5参与了胃癌细胞生长增殖的调节。PAK5的无/中表达表明肿瘤细胞进入复制分裂期的增殖数目较少、恶性度低; PAK5的中/高表达表明肿瘤细胞进入增殖期数目多、恶性度高。本研究明确影像学进展的51例患者生物学进展时刻时PAK5的中表达数值为13.6%~83%,高表达数值为37.8%~100%。结果显示PAK5的中/高表达可预测生物学进展,实验数据范围较广,我们考虑PAK5检测的敏感度和特异性可能会导致假阳性/假阴性。但因为例数较少,未行统计学分析。
本研究数据单因素检测存在误差,对癌培抗原进行性增高组影像学进展确定进展的39例患者进行CEA、PAK5、CTC三者联合检测的一致性上,预测生物学进展的一致率为82%;预测肿瘤影像学进展的一致率为94%,联合检测可提高预测率,降低检测误差。
因此,联合动态检测CEA、PAK5、CTC预测ⅢB期胃癌术后生物学进展,更早于影像进展诊断,可降低单一指标的假阳/阴性率,提高检出阳性率,防止漏诊、误诊的发生。
作者贡献陈梦雪:数据收集、统计,文章撰写桑楠:病理诊断葛献:数据收集陈嘉希、黄倩:数据统计李学良:数据校对及文章修改 -
表 1 214个表浅型食管癌病变部位经内镜黏膜下剥离术导致非治愈性切除的单因素分析
Table 1 Univariate analysis of non-curative resection after ESD in 214 SEC lesions

表 2 214处表浅型食管癌病变部位经内镜黏膜下剥离术导致非治愈性切除多因素分析
Table 2 Multivariate analysis of non-curative resection after ESD in 214 SEC lesions

表 3 26例未追加其他额外治疗患者的非治愈切除因素
Table 3 Non-curative resection factors in 26 patients without additional treatment

表 4 未追加其他治疗的11例复发患者的非治愈性切除因素
Table 4 Non-curative resection factors in 11 recurrent patients without additional treatment

表 5 非治愈及治愈性切除复发率、生存率及死亡率详值(%)
Table 5 Recurrence rate, survival rate and mortality rate of non-curative and curative resection (%)

-
[1] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. doi: 10.3322/caac.21338
[2] 国家卫生健康委员会.食管癌诊疗规范(2018年版)[J].肿瘤综合治疗电子杂志, 2019, 5(2): 50-86. http://d.old.wanfangdata.com.cn/Periodical/zhxhbyyxzz201904005 National Health Commission. Esophageal cancer diagnosis and treatment standard (2018 edition)[J]. Zhong Liu Zong He Zhi Liao Dian Zi Za Zhi, 2019, 5(2): 50-86. http://d.old.wanfangdata.com.cn/Periodical/zhxhbyyxzz201904005
[3] Ohashi S, Miyamoto S, Kikuchi O, et al. Recent Advances From Basic and Clinical Studies of Esophageal Squamous Cell Carcinoma[J]. Gastroenterology, 2015, 149(7): 1700-1715. doi: 10.1053/j.gastro.2015.08.054
[4] Oyama T, Tomori A, Hotta K, et al. Endoscopic Submucosal Dissection of Early Esophageal Cancer[J]. Clin Gastroenterology Hepatology, 2005, 3(7): S67-S70. doi: 10.1016/S1542-3565(05)00291-0
[5] Alsop BR, Sharma P. Esophageal Cancer[J]. Gastroenterol Clin North Am, 2016, 45(3): 399-412. doi: 10.1016/j.gtc.2016.04.001
[6] Choi JH, Kim ES, Lee YJ, et al. Comparison of quality of life and worry of cancer recurrence between endoscopic and surgical treatment for early gastric cancer[J]. Gastrointest Endosc, 2015, 82(2): 299-307. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=a652b033986577f2c4de6e7ff9b42537
[7] Barret M, Prat F. Diagnosis and treatment of superficial esophageal cancer[J].Ann Gastroenterol, 2018, 31(3): 256-265. http://d.old.wanfangdata.com.cn/Periodical/qlzlzz201123008
[8] Libânio D, Pimentel-Nunes P, Afonso LP, et al. Long-Term Outcomes of Gastric Endoscopic Submucosal Dissection: Focus on Metachronous and Non-Curative Resection Management[J]. GE Port J Gastroenterol, 2017, 24(1): 31-39. https://www.karger.com/Article/FullText/450874
[9] Zhang HZ, Jin GF, Shen HB. Epidemiologic differences in esophageal cancer between asian and western populations[J]. Chin J Cancer, 2012, 31(6): 281-286. doi: 10.5732/cjc.011.10390
[10] Toyokawa T, Inaba T, Omote S, et al. Risk Factors for Non-Curative Resection of Early Gastric Neoplasms with Endoscopic Submucosal Dissection: Analysis of 1, 123 Lesions[J]. Exp Ther Med, 2015, 9(4): 1209-1214. doi: 10.3892/etm.2015.2265
[11] Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T, et al. Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy(ESGE) Guideline[J]. Endoscopy, 2015, 47(9): 829-854. doi: 10.1055/s-0034-1392882
[12] Maes S, Haidry R, Bisschops R. Can the depth of invasion of early esophageal cancer be predicted based on endoscopic appearances?[J]. Minerva Chir, 2018, 73(4): 385-393. https://www.researchgate.net/publication/326607833_Can_the_depth_of_invasion_of_early_esophageal_cancer_be_predicted_based_on_endoscopic_evidence
[13] Min YW, Lee H, Song BG, et al. Comparison of endoscopic submucosal dissection and surgery for superficial esophageal squamous cell carcinoma: a propensity score-matched analysis[J]. Gastrointest Endosc, 2018, 88(4): 624-633. doi: 10.1016/j.gie.2018.04.2360
[14] Zhang Y, Ding H, Chen T, et al. Outcomes of Endoscopic Submucosal Dissection vs. Esophagectomy for T1 Esophageal Squamous Cell Carcinoma in a Real-world Cohort[J]. Clin Gastroenterol Hepatol, 2019, 17(1): 73-81. https://www.ncbi.nlm.nih.gov/pubmed/29704682
[15] Lee JW, Cho CJ, Kim DH, et al. Long-Term Survival and Tumor Recurrence in Patients with Superficial Esophageal Cancer after Complete Non-Curative Endoscopic Resection: A Single-Center Case Series[J]. Clin Endosc, 2018, 51(5): 470-477. doi: 10.5946/ce.2018.025
[16] Qi ZP, Chen T, Li B, et al. Endoscopic submucosal dissection for early esophageal cancer in elderly patients with relative indications for endoscopic treatment[J]. Endoscopy, 2018, 50(9): 839-845. doi: 10.1055/a-0577-2560
-
期刊类型引用(2)
1. 李伟,韩晓峦,杨质彬,何阿仃,韩楠男,张春叶,阮敏,王元银. 原发性舌鳞癌MRI浸润深度与病理浸润深度的相关性研究. 中国肿瘤临床. 2024(19): 974-979 .  百度学术
百度学术
2. 安星妃,章礼玉,彭晖,王倩,翁海燕,周瑜. 淋巴结产量及淋巴结比率在cN0口腔鳞癌中的预后价值分析. 中国口腔颌面外科杂志. 2024(06): 563-571 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载: