-
摘要:目的
分析骨巨细胞瘤特点与术后复发的相关性。
方法回顾性分析获得随访的451例骨巨细胞瘤患者发病部位、手术方式、Campanacci分级、病理性骨折、肺转移与骨巨细胞瘤复发率的相关性。
结果脊柱骨盆骨巨细胞瘤的复发率较膝关节周围(P < 0.001)、桡骨远端(P=0.005)及其他部位(P < 0.001)骨巨细胞瘤复发率高;Ⅲ级骨巨细胞瘤单纯刮除术后复发率高于扩大刮除术(P < 0.001)以及瘤段或分块切除术(P=0.002),差异有统计学意义;行单纯刮除术的CampanacciⅠ级、Ⅱ级、Ⅲ级骨巨细胞瘤术后复发率比较差异有统计学意义(P=0.028),行扩大刮除及瘤段或分块切除术后的CampanacciⅡ级与Ⅲ级的骨巨细胞瘤复发率比较差异无统计学意义(P > 0.05);骨巨细胞瘤复发病例肺转移率高于无复发病例肺转移率,差异有统计学意义(P < 0.001);伴病理性骨折与无病理性骨折骨巨细胞瘤术后复发率比较差异无统计学意义(P > 0.05)。
结论手术方式影响骨巨细胞瘤的肿瘤外科边界,与术后复发率密切相关;复发病例的肺转移率明显升高;为改善骨巨细胞瘤患者预后,临床上骨巨细胞瘤手术应考虑足够的外科边界。
Abstract:ObjectiveTo investigate the relationship between the characteristics and postoperative recurrence of giant cell tumor (GCT) of bone.
MethodsA total of 451 patients followed up with GCT of bone undergoing surgical treatment were reviewed to analyze the association of the characteristics, including tumor location, operation method, Campanacci grade, pathological fracture and pulmonary metastasis, with the recurrence rate of GCT bone.
ResultsThe recurrence rate of GCT in the spine or pelvis was significantly higher than that around the knee (P < 0.001), in distal radius (P=0.005) and in other parts (P < 0.001). The recurrence rate of grade Ⅲ GCT after simple excochleation was significantly higher than that after enlarged excochleation (P < 0.001) and tumor segment or block resection (P=0.002). The recurrence rate of GCT undergoing simple excochleation among cases of Campanacci gradeⅠ, Ⅱ and Ⅲ was significantly different (P=0.028); however, for GCT undergoing enlarged excochleation and tumor segment or block resection, there was no statistically significant difference of the recurrence rate between cases of gradeⅡ and Ⅲ (P > 0.05). The pulmonary metastasis rate in the recurrence cases of GCT was significantly higher than that in no recurrence cases (P < 0.001). There was no statistically significant difference of the recurrence rate of GCT between cases with and without pathological fracture (P > 0.05).
ConclusionThe surgical procedure affects the surgical boundary of GCT, which is closely related to the postoperative recurrence rate; the pulmonary metastasis rate of recurrent cases is significantly increased; adequate surgical boundaries for the surgical treatment of GCT may be essential to improve the prognosis of patients with GCT.
-
Key words:
- Giant cell tumor of bone /
- Postoperative recurrence /
- Cause analysis /
- Surgical treatment
-
0 前言
多发性骨髓瘤(multiple myeloma, MM)是一种浆细胞恶性克隆增殖性疾病[1]。在过去数十年里,通过对骨髓瘤细胞生物学特性及其骨髓微环境的深入理解,开发了多种新的治疗策略,明显提高了患者生存期。但由于骨髓瘤的异质性、易复发及耐药性,目前MM仍无法治愈。免疫检查点抑制剂(immune checkpoint inhibitors, ICIs),如靶向程序性死亡因子-1(programmed death-1, PD-1)/程序性死亡配体1/2(programmed death-ligand 1/2, PD-L1/2)药物在实体瘤治疗中的成功应用已使免疫疗法成为抗肿瘤治疗的研究热点,也为MM的免疫治疗带来了新的希望。
1 免疫因素与MM发病机制
MM的发病机制尚不清楚,可能与长期慢性感染、染色体畸变及癌基因激活等相关,近年来免疫因素在MM疾病演变中的作用越来越受重视。研究显示由于MM患者骨髓微环境异常,诱导产生的转化生长因子-β(transforming growth factor-β, TGF-β)、IL-10和IL-6可限制树突细胞(dendritic cell, DC)活化T细胞,导致抗原提呈不良和肿瘤特异性免疫反应欠佳,TGF-β还可通过抑制IL-2自分泌途径抑制B/T细胞活化[1-2];另外,异常状态的骨髓微环境亦可通过多种通路上调免疫或肿瘤细胞负性共刺激分子表达并抵抗NK细胞的溶解作用,进一步抑制免疫细胞导致机体免疫障碍,造成肿瘤细胞免疫逃逸[2-3]。由此MM的发生发展与骨髓微环境异常密切相关,其中免疫细胞的免疫监视功能障碍在MM的发生发展中起了重要作用。临床上多数MM患者初诊时已处于Durie-Salmon分期Ⅱ~Ⅲ期,多伴有严重的免疫功能障碍(表现为表型和功能缺陷),因此免疫疗法可能成为治疗MM患者的重要手段。
1.1 PD-1/PD-L1/2轴的发现与完善
目前认为PD-1主要在活化和衰竭的T细胞、B细胞和骨髓微环境中表达,部分还可表达于NK及NKT细胞[1];PD-L1在浆细胞、骨髓来源的抑制细胞及抗原提呈细胞中表达,此外还见于免疫细胞亚群、各种组织细胞及其他非造血细胞如单核细胞、内皮细胞和上皮细胞[1];PD-L2与PD-1的亲和力是PD-L1的2~6倍,主要在抗原提呈细胞、B细胞及正常组织上表达[4-5]。由于PD-L1和PD-L2在不同特异性T细胞表达,因此他们与PD-1相互作用时不会发生交叉反应[5]。
肿瘤状态下,PD-L1/2在肿瘤微环境中的肿瘤细胞、免疫细胞及间质细胞表达,当表达PD-1的免疫细胞与肿瘤细胞PD-L1/2受体结合后可使前者胞质结构域中的免疫受体酪氨酸基转换基序(immunoreceptor tyrosine-based switch motif, ITSM)招募并激活蛋白酪氨酸激酶,使近端信号分子去磷酸化,抑制ZAP-70磷酸化,抑制免疫细胞增殖与分化及Ig的分泌,减弱Ras-MAPK途径、PKC途径和钙-钙调素途径的作用,同时抑制炎性细胞因子的释放、增加Treg细胞生成,进一步减弱免疫反应达到肿瘤免疫逃逸,导致机体免疫受抑和化疗抵抗[6]。幸运的是阻断此通路可恢复免疫细胞活性进而提升抗肿瘤能力,这为PD-1/PD-L1/2通路治疗MM提供了理论基础。
1.2 PD-1、PD-L1/2在多发性骨髓瘤中的表达
MM中PD-1的表达在不同的研究中得出不同的结论。现有多数研究发现PD-1的表达多见于CD4+T淋巴细胞、CD8+T淋巴细胞、NK/NKT细胞[1]。2015年Görgün等[7]研究发现与正常人群相比,新诊断的多发性骨髓瘤(newly diagnosed multiple myeloma, NDMM)及复发/难治性多发性骨髓瘤(relapsed and refractory multiple myeloma, RRMM)患者CD8+T淋巴细胞、NK/NKT细胞中PD-1的表达均升高。我国研究小组也得出相似结论并证实PD-1的表达与临床分期、疾病严重程度及疗效有相关性[8-9],也有学者得出相反的结论[10]。同期研究也表明对于RRMM和微小残留病变阳性患者T淋巴细胞PD-1的表达显著增加[11]。PD-1在NK细胞中的表达的相关研究早在2010年就已开展,且各小组得出了不同的结果:多数研究发现PD-1在MM患者的NK细胞中高表达,而在健康组人群的NK细胞中不表达[11];少部分数据认为PD-1在NK细胞中不表达[12]。
PD-L1在MM正常浆细胞中不表达,但在肿瘤细胞及化疗耐药的增殖前体细胞中表达[13],骨髓微环境中的其他免疫细胞如DC、骨髓来源的抑制细胞、浆细胞样树突细胞及骨髓间充质干细胞部分表达PD-L1[14]。研究发现与意义未明的单克隆免疫球蛋白血症相比,MM肿瘤细胞中PD-L1表达更明显[15],且无论PD-1的表达如何,PD-L1的表达都有增加的趋势,淋巴细胞浸润数量与疾病无进展生存期负相关[16],提示PD-L1的表达与疾病恶性转化的风险有关。然而也有研究并未发现PD-L1过表达[11],且其表达水平与MM的分期、有无靶器官受损无明显相关性[14]。
PD-L2在MM中的研究非常有限。目前,研究认为其多见于各种免疫细胞和肿瘤细胞[17]。血液系统相关研究表明PD-L2在骨髓瘤细胞中的表达比例远高于急性白血病和慢性淋巴细胞白血病(61.9%、14.3%和10.0%)[4],此外,其在经典霍奇金淋巴瘤、滤泡性淋巴瘤及急性髓样白血病细胞以及髓样来源的抑制细胞中的表达明显升高[5]。
1.3 PD-1/PD-L1/2通路在MM的作用机制
当机体异常浆细胞经过清除期、平衡期和免疫逃逸期,成为具备抵抗免疫系统清除功能的骨髓瘤细胞时,其特异性抗原会被机体免疫细胞(如T、B淋巴细胞)识别并攻击,活化的T淋巴细胞表达PD-1,产生的γ链细胞因子与活化的CD19+B淋巴细胞产生的IL-21、单核细胞和非淋巴细胞产生的干扰素-γ(interferon-γ, IFN-γ)共同诱导肿瘤细胞及免疫细胞中PD-L1的表达上调,活化的B淋巴细胞中的脂多糖和B细胞受体不仅可上调PD-L1的表达,其与DC中的粒细胞-巨噬细胞集落刺激因子及IL-4共同诱导PD-L2的表达[18-19],上调的PD-1与PD-L1/2的结合可抑制T细胞增殖,导致T淋巴细胞衰老和凋亡,并抑制细胞毒性T淋巴细胞(cytotoxic lymphocyte, CTL)的杀伤作用,最终形成免疫抑制性微环境,这种异常状态的骨髓微环境诱导产生的TGF-β、IL-10和IL-6进一步抑制T淋巴细胞的活化,同时通过PI3K/Akt、JAK/STAT3、RAS/RAF/MEK/ERK和NF-κB等多种通路上调免疫细胞或肿瘤细胞中PD-1/PD-L1/2的表达造成机体免疫障碍,导致骨髓瘤细胞迁移和增殖[20-21],这种共抑制途径被认为是PD-1/PD-L1/2通路使MM免疫细胞功能受损的主要机制。但是近期也有研究认为表达PD-L2的T淋巴细胞可识别其他肿瘤细胞及免疫细胞的特异性抗原,可诱导辅助T细胞IFN-γ等细胞因子的释放,直接或间接发挥抗肿瘤免疫作用,与更好的预后相关[5]。
2 MM免疫治疗进展
目前MM的治疗包括蛋白酶体抑制剂、免疫调节剂如来那度胺(Lenalidomide, Len)和泊马度胺(Pomalidomide, Pom)、单克隆抗体如Daratumumab、Elotuzumab和组蛋白去乙酰化酶Panobinostat、ICIs及过继细胞疗法等,这些治疗方法的不断研发使MM的预后得到显著改善, 其中位生存期不断延长。
PD-1/PD-L1/2是具有抑制特性的蛋白质,作为单克隆抗体潜在靶点最初用于黑色素瘤、肺癌及肾细胞癌等实体瘤的治疗,获得了很高的应答率[14]。在血液系统疾病中最初用于经典型霍奇金淋巴瘤的治疗[1],在MM中的研究相对较晚,多项研究表明MM单用ICIs的疗效不如实体瘤[2, 18],与其他基础治疗方案联用可得到令人满意的结果,但随之带来的如心肌炎、骨髓抑制、腹泻等不可预知的免疫相关不良反应(immune-related adverse events, irAEs)使部分临床试验终止。如果能解决上述问题,PD-1/PD-L1/2的免疫疗法将有望成为提高或取代现有MM标准治疗、为患者提供更长生存期的新途径。
2.1 Pembrolizumab
Pembrolizumab是针对PD-1的单克隆抗体。早期临床前试验提示T细胞PD-1上调与疾病复发和化疗抵抗相关,那么通过Pembrolizumab阻断PD-1/PD-L1通路或许是一种新的治疗选择。
2013年评估Pembrolizumab对血液系统恶性肿瘤治疗的安全性、耐受性和有效性的Ⅰb期临床试验研究表明,单用Pembrolizumab在纳入的30例RRMM中具有良好的耐受性,17例患者达疾病稳定(stable disease, SD),疾病控制率(disease control rate, DCR)达56.7%,与其在其他癌症中的安全性一致[22]。2015年开展的Pembrolizumab对大剂量化疗和自体造血干细胞移植后淋巴细胞减少状态的MM治疗的Ⅱ期临床试验研究表明纳入的32例患者中非常好的部分缓解患者占31%,部分缓解(partial response, PR)率达69%,且2年无进展生存率高达83%[23]。上述研究提示单用Pembrolizumab具有客观的反应,然而考虑到研究样本量少且无对照组,得出的研究结果具有一定的局限性。2014年开展了Pembrolizumab联合Len和低剂量地塞米松(Dexamethasone, Dex)治疗RRMM有效性和安全性评估的Ⅰ期多队列试验[24],接受试验的62例患者DCR达94%,客观缓解率(objective response rate, ORR)为44.0%。由Badros等[16]开展的Pembrolizumab联合Pom与Dex对48例RRMM患者治疗的研究结果发现:60%出现客观缓解,包括4例严格意义的CR、9例非常好的PR(VGPR)和16例PR。这些数据为Pembrolizumab联合疗法提供了强有力的支撑,然而新问题的出现阻碍了试验进展——上述试验的不良反应率均达90%以上,面临相同处境的还有Pom+小剂量Dex±Pembrolizumab方案治疗RRMM及Len+小剂量Dex±Pembrolizumab方案治疗NDMM的试验[22, 25-26],两项试验的irAEs及死亡人数在使用单抗组中均高于不使用单抗组,且RRMM患者更常见,这使该试验被迫终止。有关Pembrolizumab联合Len与Dex方案治疗符合干细胞移植条件的NDMM的临床试验(NCT02880228)也得出相似结论——不良反应率达100.00%,其中严重不良反应约27.27%。虽然上述研究小组未公布不良事件与Pembrolizumab联合疗法之间的确切关系,基于患者的安全性,仍需引起我们的警惕与思考。通过分析终止试验的两项研究数据发现,各治疗组之间患者疾病特征不平衡,多数入组患者疾病预后不佳,去除影响均衡性因素后,再次评估两治疗组之间的不良事件死亡人数时,发现两组差异并无统计学意义,所以不排除整个研究结论的片面性。目前Pembrolizumab单药以及联合Pemigatinib、放射疗法、NY-ESO-1 c259T、GSK2857916、柠檬酸依沙米布等治疗MM的临床试验尚在进行中。
2.2 Nivolumab
Nivolumab也是针对PD-1的单克隆抗体。研究表明Nivolumab与PD-1的结合亲和力非常高,1天内单次注射3 mg/kg可达到80%的饱和度[27],将其用于治疗MM的方案似乎可行,然而Lesokhin等[28]纳入27例RRMM的Ⅰb期临床试验提示Nivolumab单药治疗几乎无效[28]。Pianko等[29]纳入27例RRMM进行Nivolumab单药和联合疗法的对照试验,显示单药疗法结果和Lesokhin的研究一致,而接受Nivolumab联合Ipilimumab治疗的19例患者的ORR达47%,显示出联合疗法的有效性。总体来说Nivolumab联合疗法治疗MM似乎可行。目前Nivolumab联合Elotuzumab、放疗、CAR-T细胞及肿瘤融合细胞疫苗等其他疗法的研究正在进行中。
2.3 Pidilizumab
Pidilizumab是另一个针对PD-1的单克隆抗体。目前针对Pidilizumab用于治疗MM的临床试验只有3项。Berger等[30]对17例晚期血液系统恶性肿瘤的患者进行Ⅰ期Pidilizumab剂量递增临床试验,其中包括1例既往未接受任何治疗的ⅠA期IgG-κ型MM,治疗后达SD且CD4+T淋巴细胞增加,无明显的不良反应,如此令人鼓舞的临床反应似乎提示Pidilizumab是一种安全、耐受性好的药物。Pidilizumab联合Len或联合DC及骨髓瘤细胞疫苗治疗RRMM的试验(NCT02077959/NCT01067287)结果待公布。总体来说Pidilizumab治疗MM有良好的应答率。
2.4 Durvalumab
Durvalumab是针对PD-L1的单克隆抗体,为确定该药最佳剂量和治疗方案及安全性和有效性,2015年Celgene[31]开展了单用Durvalumab或与Pom联合或不联合低剂量地塞米松治疗RRMM的Ⅰ期临床试验,然而由于之前Pembrolizumab联合疗法带来的高不良反应率,使该试验被暂停;同样被暂停的还有临床反应欠佳或存在严重不良反应的Pembrolizumab联合Tremelimumab或Daratumumab的研究(NCT02716805/NCT02807454)。一项为确定接受Durvalumab与Len联合或不联合Dex的推荐剂量和方案的临床试验纳入了56例NDMM患者,分为高风险不适合移植、≥65岁不适合移植及高风险移植后三组,前两组接受Durvalumab和Len联合Dex、高风险移植后组不联合Dex治疗,公布的部分数据表明严重不良事件发生率为50%左右[32]。2017年美国Memorial肿瘤研究中心开展了Durvalumab联合放疗治疗孤立性骨髓浆细胞瘤伴有限克隆性骨髓浆细胞增多症患者的临床试验,目前结果尚未公布。总体而言Durvalumab单药或联合疗法治疗MM结果不尽人意。
2.5 Atezolizumab
Atezolizumab也是针对PD-L1的单克隆抗体,可通过抑制PD-L1恢复T细胞的抗肿瘤活性。早期数据提示Atezolizumab联合治疗MM具有很大的潜力。Cho[33]开展的评估Atezolizumab治疗复发或接受过自体干细胞移植MM安全性的Ⅰ期临床试验纳入了24例RRMM患者,该研究分为6组:A组单用Atezolizumab;B和C组为Atezolizumab+Len的剂量递增试验;D、E、F组分别为Atezolizumab+Daratumumab、Atezolizumab+Daratumumab+Len、Atezolizumab+Pom+Dex的试验,目前公布的部分结果表明D、E、F组接受治疗的患者ORR均高于50%,且多药联用患者临床反应更深刻而持久,展示出联合疗法的益处。对RRMM使用Atezolizumab+Cobimetinib+Venetoclax联合化疗方案的生物学和临床作用的研究结果待公布(NCT03312530)(https://www.clinicaltrials.gov/)。
上述有关PD-1单抗的单药疗法的疗效多数并不好,而联合治疗显示出了较高临床应答率,其原因可能与MM突变负荷以及免疫细胞浸润程度相较于实体瘤较低、MM免疫抑制源于T细胞衰老而非表达抑制蛋白、免疫细胞如T细胞及病毒抗原特异性记忆T细胞终生骨髓瘤抗原暴露并与肿瘤微环境相互作用致免疫抑制、患者发病年龄较大且自身免疫状况和耐受力差,易导致严重irAEs发生有关。目前有关PD-L1单抗的疗效尚不明确,有关PD-L2的研究更是有限。仅根据现有数据发现,联合疗法有着一定的优越性,且PD-L2单抗与PD-L1单抗似乎可以发挥互补作用。基于现有MM的研究太少、样本量太小以及各研究小组试验条件不同,现有临床试验结论仍有待考究,期待后续大样本研究数据能为我们带来惊喜。
3 结语
MM的发生发展与肿瘤微环境中免疫和肿瘤等细胞PD-1/PD-L1/2表达上调有关,阻断PD-1/L1/2通路的免疫疗法从临床前实验成功走向临床并展示出很好的应用前景,显示出免疫疗法治疗MM的可行性。然而现有数据表明免疫疗法只能使部分患者获益,且单独应用免疫疗法的疗效往往有限,联合疗法虽然临床反应率高,试验过程出现的如药物安全性等很多需要解决的问题,使PD-1/L1/2通路的免疫疗法在MM的治疗中仍处于辅助地位。因此仔细和全面探讨现有结果的原因、找出更为安全有效的治疗方案显得尤为重要,相信PD-1/PD-L1/2免疫疗法将在未来MM治疗中展示出潜力并造福患者。
作者贡献吴朝阳: 资料收集黄琳珊、王生淋: 起草文稿沈荣凯: 参与统计分析陈飞、林建华: 参与文稿撰写及修改朱夏: 研究的构思,帮助修改文稿 -
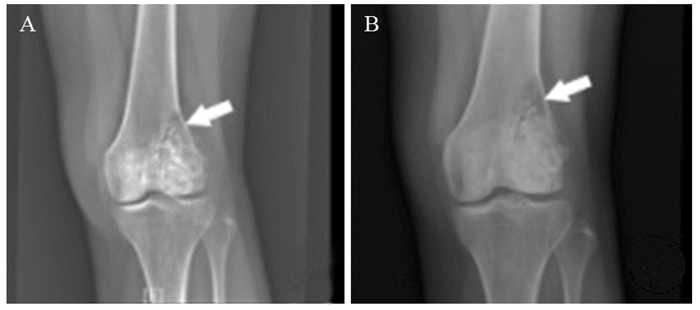
表 1 451例骨巨细胞瘤患者的发病部位
Table 1 Location of giant cell tumor of bone

表 2 发病部位与骨巨细胞瘤复发率的关系
Table 2 Relationship between tumor location and recurrence rate of giant cell tumor of bone

表 3 手术方式与骨巨细胞瘤复发率的关系
Table 3 Relationship between operation method and recurrence rate of giant cell tumor of bone

表 4 Campanacci分级与骨巨细胞瘤复发率关系
Table 4 Relationship between Campanacci grade and recurrence rate of giant cell tumor of bone

表 5 部分临床参数与骨巨细胞瘤复发率关系
Table 5 Relationship between characteristics and recurrence rate of giant cell tumor of bone

-
[1] Van der Heijden L, Dijkstra PD, van de Sande MA, et al. The clinical approach toward giant cell tumor of bone[J]. Oncologist, 2014, 19(5): 550-61. doi: 10.1634/theoncologist.2013-0432
[2] Klenke FM, Wenger DE, Inwards CY, et al. Giant cell tumor of bone: risk factors for recurrence[J]. Clin Orthop Relat Res, 2011, 469(2): 591-9. doi: 10.1007/s11999-010-1501-7
[3] Niu X, Zhang Q, Hao L, et al. Giant cell tumor of the extremity: retrospective analysis of 621 Chinese patients from one institution[J]. J Bone Joint Surg Am, 2012, 94(5): 461-7. doi: 10.2106/JBJS.J.01922
[4] 牛晓辉.病灶刮除骨水泥填充治疗四肢骨巨细胞瘤的效果评价[J].中国骨与关节杂志, 2016, 5(1): 29-31. doi: 10.3969/j.issn.2095-252X.2016.01.007 Niu XH. Evaluation of curettage and cement reconstruction as treatment of giant cell tumors in the extremitjes[J]. Zhongguo Gu Yu Guan Jie Za Zhi, 2016, 5(1): 29-31. doi: 10.3969/j.issn.2095-252X.2016.01.007
[5] Sobti A, Agrawal P, Agarwala S, et al. Giant Cell Tumor of Bone-An Overview[J]. Arch Bone Jt Surg, 2016, 4(1): 2-9. http://europepmc.org/articles/PMC4733230
[6] Reid R, Banerjee S, Sciot R. Giant cell tumours//Fletcher CDM, Unni KK, Mertens F, eds. World Health Organization classification of tumors. Pathology and genetics of tumors of soft tissue and bone[M]. Lyon: IARC Press, 2002: 309-13.
[7] Wülling M, Delling G, Kaiser E. The origin of the neoplastic stromal cell in giant cell tumor of bone[J]. Hum Pathol, 2003, 34(10): 983-93. doi: 10.1053/S0046-8177(03)00413-1
[8] Klenke FM, Wenger DE, Inwards CY, et al. Recurrent giant cell tumor of long bones: analysis of surgical management[J]. Clin Orthop Relat Res, 2011, 469(4): 1181-7. doi: 10.1007/s11999-010-1560-9
[9] Errani C, Ruggieri P, Asenzio MA, et al. Giant cell tumor of the extremity: A review of 349 cases from a single institution[J]. Cancer Treat Rev, 2010, 36(1): 1-7. doi: 10.1016-j.ctrv.2009.09.002/
[10] Deheshi BM, Jaffer SN, Griffin AM, et al. Joint salvage for pathologic fracture of giant cell tumor of the lower extremity[J]. Clin Orthop Relat Res, 2007, 459: 96-104. doi: 10.1097/BLO.0b013e31805d85e4
[11] Campanacci M, Baldini N, Boriani S, et al. Giant-cell tumor of bone[J]. J Bone Joint Surg Am, 1987, 69(1): 106-14. doi: 10.2106/00004623-198769010-00018
[12] Cheng CY, Shih HN, Hsu KY, et al. Treatment of giant cell tumor of the distal radius[J]. Clin Orthop Relat Res, 2001, 383: 221-8. doi: 10.1097/00003086-200102000-00026
[13] 中国医师协会骨科医师分会, 骨肿瘤专业委员会.骨巨细胞瘤临床循证诊疗指南[J].中华骨与关节外科杂志, 2018, 11(4): 276-87. doi: 10.3969/j.issn.2095-9958.2018.04.004 Zhongguo Yi Shi Xie Hui Gu Ke Yi Shi Fen Hui, Gu Zhong Liu Zhuan Ye Wei Yuan Hui. Guideline for clinical evidence-based diagnosis and treatment of giant cell tumor of bone[J]. Zhonghua Gu Yu Guan Jie Wai Ke Za Zhi, 2018, 11(4): 276-87. doi: 10.3969/j.issn.2095-9958.2018.04.004
[14] 郭卫, 李大森, 杨毅, 等.脊柱骨巨细胞瘤的手术治疗策略[J].中国脊柱脊髓杂志, 2009, 19(12): 899-903. doi: 10.3969/j.issn.1004-406X.2009.12.04 Guo W, Li DS, Yang Y, et al. Surgical strategy for spinal giant cell tumor[J]. Zhongguo Ji Zhu Ji Sui Za Zhi, 2009, 19(12): 899-903. doi: 10.3969/j.issn.1004-406X.2009.12.04
[15] 郭卫, 汤小东, 李晓, 等.骨盆和骶骨骨巨细胞瘤的治疗策略[J].中华外科杂志, 2008, 46(7): 501-5. doi: 10.3321/j.issn:0529-5815.2008.07.006 Guo W, Tang XD, Li X, et al. The analysis of the treatment of giant cell tumor of the peIvis and sacrum[J]. Zhonghua Wai Ke Za Zhi, 2008, 46(7): 501-5. doi: 10.3321/j.issn:0529-5815.2008.07.006
[16] 王臻, 郭征, 李松建, 等.骨巨细胞瘤组织周边生物学行为研究[J].中国骨科临床与基础研究杂志, 2012, 4(1): 36-41. doi: 10.3969/j.issn.1674-666X.2012.01.006 Wang Z, Guo Z, Li JS, et al. Study on the oncobiological behavior at the peripheral tissues of bone giant cell tumor[J]. Zhonguo Gu Ke Lin Chuang Yu Ji Chu Yan Jiu Za Zhi, 2012, 4(1): 36-41. doi: 10.3969/j.issn.1674-666X.2012.01.006



 下载:
下载:



