Afatinib Sensibilizes Multidrug-resistant Human Ovarian Cancer Cells to Adriamycin and Related Mechanisms
-
摘要:目的
探讨阿法替尼增强耐药性卵巢癌细胞对阿霉素化疗敏感度的作用及机制。
方法MTT法检测联用阿法替尼对阿霉素作用于卵巢癌A2780及A2780T细胞的IC50的影响;不同浓度的阿法替尼干预后,罗丹明123蓄积实验检测ABCB1外排功能;ABCB1-GloTM Assay Systems实验检测ABCB1 ATPase活性;Western blot检测A2780T细胞EGFR、p-EGFR、HER-2、p-HER-2及ABCB1的表达;RT-PCR实验检测A2780T细胞MDR1 mRNA的表达。
结果无毒浓度的阿法替尼显著降低了阿霉素对耐药卵巢癌A2780T细胞的IC50(P < 0.05),而对A2780细胞没有影响;阿法替尼浓度依赖性地增加罗丹明123在A2780T细胞内的蓄积量及ABCB1 ATPase活性(P < 0.05);阿法替尼下调A2780T细胞ABCB1的编码基因MDR1的mRNA水平及ABCB1的蛋白表达水平,抑制了EGFR及HER-2的磷酸化水平。
结论阿法替尼可能通过抑制ABCB1转运体的外排功能,下调ABCB1的表达,进而增敏耐药卵巢癌细胞A2780T对阿霉素的化疗敏感度,是一种有开发前景的卵巢癌化疗增敏剂。
Abstract:ObjectiveTo investigate the effect of afatinib on the chemosensitization of multidrug-resistant A2780T cells to adriamycin and related mechanism.
MethodsMTT assay was used to investigate the effect of afatinib on the IC50 values of adriamycin in A2780 and A2780T cells. The efflux function and ATPase activity of ABCB1 were investigated by rhodamine 123 accumulation assay and ABCB1-GloTM Assay Systems, respectively. The expression of EGFR, HER-2, p-EGFR, p-HER-2 and ABCB1 were investigated by Western blot. RT-PCR assay was applied to test the mRNA expression of MDR1 in A2780T cells.
ResultsAfatinib at nontoxic concentrations significantly decreased the IC50 of adriamycin in A2780T cells (P < 0.05), while no effect in A2780 cells. Afatinib could inhibit the efflux function and increase the ATPase activity of ABCB1 in a concentration-dependent manner(P < 0.05). Afatinib inhibited the phosphorylation of EGFR and HER-2, and decreased the expression of ABCB1 protein and MDR1 mRNA in A2780T cells.
ConclusionAfatinib could sensibilize multidrug-resistant A2780T cells to adriamycin by inhibiting the efflux function and downregulating ABCB1 expression.
-
Key words:
- Afatinib /
- Ovarian cancer /
- Adriamycin /
- Chemosensitization
-
0 引言
卵巢癌是女性生殖系统常见的恶性肿瘤之一,发病率仅次于子宫颈癌及子宫体癌,但导致的死亡数却多于其他妇科恶性肿瘤总和,严重威胁女性生命健康[1-2]。复发性卵巢癌患者的平均生存期仅1年[3]。化疗失败导致卵巢癌广泛腹盆腔转移,严重影响晚期卵巢癌患者的生存质量。因此筛选及开发卵巢癌化疗增敏剂具有重要的临床意义。
阿霉素是广谱的蒽环类抗肿瘤药物,在临床上广泛用于卵巢癌、乳腺癌、肺癌、膀胱癌、胃癌及白血病等肿瘤的治疗。耐药性的产生是影响阿霉素临床抗肿瘤疗效的关键,因此,对阿霉素进行剂型改造或者筛选化疗增敏剂作为阿霉素的联用药物,进而增强阿霉素化疗疗效,逆转其多药耐药性,是肿瘤领域的研究热点之一[4-5]。表皮生长因子受体(EGFR)及人表皮生长因子受体2(HER-2)的异常表达和激活,与多种恶性肿瘤的发生发展密切相关。阿法替尼是首个不可逆的靶向EGFR及HER-2双受体起效的酪氨酸激酶抑制剂类(tyrosine kinase inhibitors, TKIs)药物,2017年获批用于EGFR基因突变阳性的非小细胞肺癌患者的临床治疗,其用于其他实体瘤的临床试验也正在广泛开展中[6-8],目前已有阿法替尼增敏铂类药物化疗效果的报道,但阿法替尼对阿霉素这一临床常用化疗药物疗效的影响如何尚未见报道。本研究通过探讨阿法替尼增强耐药卵巢癌细胞对阿霉素化疗敏感度的作用及机制,为其作为化疗增敏剂应用于耐药性卵巢癌的临床化疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞株
人卵巢癌细胞株A2780及其耐药株A2780T购自南京凯基生物科技有限公司;A2780细胞培养于含10%胎牛血清、1%青-链霉素双抗的DMEM培养液中;A2780T细胞培养于含10%胎牛血清、1%青-链霉素双抗的RPMI1640培养液中,并加入800 ng/ml的紫杉醇以维持其多药耐药性。
1.1.2 主要试剂
阿法替尼(CAS:439081-18-2,批号20120406,纯度 > 99%)及阿霉素(纯度>98%)购自大连美仑生物技术有限公司;RPMI1640、DMEM培养液、胰蛋白酶及胎牛血清购自美国Gibco公司;双抗溶液购自杭州吉诺生物医药技术有限公司;MTT(即3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)购于美国Sigma公司;ABCB1特异性siRNA由上海吉码生物科技有限公司合成;LipofectamineTM 2000购于美国Invitrogen公司;ABCB1 GloTM Assay Systems试剂盒购自美国Promega公司;ABCB1抗体(sc-8313)购自美国Santa Cruz公司;EGFR(BS3605)、p-EGFR(BS4740)、HER-2(BS1172)、p-HER-2(BS4090)及GAPDH(AP0063)抗体均购自美国Bioworld公司;RNAiso Plus、PrimeScript RT Master Mix及SYBR Premix EX Taq试剂盒购自日本TAKARA公司;其余化学试剂均为分析纯。
1.2 方法
1.2.1 MTT法筛选阿法替尼与阿霉素的联用浓度
人卵巢癌细胞A2780及A2780T接种于96孔板,密度为5 000个/孔,细胞贴壁后,各孔分别加入不同浓度的阿法替尼药液,继续培养48 h后,每孔加入5 mg/ml MTT溶液20 μl,继续孵育4 h。随后吸弃药液,加200 μl的DMSO培养液,轻轻振荡5 min后,使用多功能酶标仪于490 nm波长处测量各孔吸光度值(OD值),并根据如下公式计算:增殖抑制率=(1-实验组OD值/对照组OD值)×100%。选择对两种卵巢癌细胞抑制率不超10%时的浓度作为阿法替尼与阿霉素联用时的浓度。
1.2.2 MTT法检测卵巢癌细胞增殖
采用MTT法考察低中高浓度的阿法替尼与不同浓度的阿霉素联用时,对卵巢癌敏感株及耐药株的增殖抑制率,采用Bliss法[9]计算半数抑制浓度IC50。
增敏倍数=阿霉素对卵巢癌细胞的IC50÷联用阿法替尼时阿霉素对卵巢癌细胞的IC50
1.2.3 MTT法检测ABCB1特异性siRNA对卵巢癌细胞对阿霉素化疗敏感度的影响
通过ABCB1特异性的siRNA敲低两种卵巢癌细胞内ABCB1的表达水平。ABCB1特异性siRNA序列如下:ABCB1-上游引物:5' -GUGGGCACAAACCAGAUAATT-3',ABCB1-下游引物:5' -UUAUCUGGUUUGUGCCCACTT-3'。采用LipofectamineTM 2000用于ABCB1特异性siRNA的转染,方法参照说明书。转染48 h后提取细胞全蛋白进行Western blot实验,验证干扰效果。采用MTT法检测转染过的细胞对阿霉素的化疗敏感度。
1.2.4 罗丹明123蓄积实验检测阿法替尼对ABCB1外排功能的影响
消化收集细胞,调整细胞浓度为1×106个/毫升。随后将细胞转移至5 ml的EP管中,每管1 ml,离心弃去上清液,PBS洗涤细胞沉淀后离心弃PBS。各管分别加入含不同浓度阿法替尼及5 μg/ml的罗丹明123的完全培养液(共1.5 ml),同时设置空白组及阳性对照组(50 μmol/L维拉帕米组),置于37℃、5%CO2的孵箱中继续孵育2 h后,1 000 r/min离心3 min,收集细胞,冷PBS洗涤细胞3次后,细胞重悬,于激发波长488 nm处,发射波长530 nm处检测各组的平均荧光强度(mean fluorescence intensity, MFI)。
1.2.5 ABCB1-GloTM Assay Systems检测阿法替尼对ABCB1 ATPase活性的影响
采用Promega公司的ABCB1-GloTM Assay Systems试剂盒检测阿法替尼对ABCB1转运体ATPase活性的影响:96孔板上,各孔分别加入20 μl含不同浓度阿法替尼的Pgp-GloTM Assay Buffer。各孔加入20 μl的1.25 mg/ml的ABCB1膜制备物,37℃孵育5 min后,各孔加入10 μl的25 mmol/L MgATP,轻轻振摇96孔板,使反应体系混匀。37℃条件下孵育40 min后,将微孔板取出,常温下各孔分别加入50 μl的ATP Detection Reagent,微孔板上轻摇混匀,室温反应20 min后,于M5型多功能酶标仪检测各孔的化学发光强度值。
1.2.6 Western blot实验检测相关蛋白的表达
不同浓度的阿法替尼处理A2780T细胞48 h后,按全蛋白提取试剂盒说明书提取总蛋白,检测阿法替尼对A2780T细胞EGFR、p-EGFR、HER-2、p-HER-2及ABCB1表达的影响。
1.2.7 RT-PCR实验检测MDR1 mRNA的表达
不同浓度的阿法替尼处理A2780T细胞48 h后,采用RNAiso Plus提取总RNA,PrimeScript RT Master Mix试剂盒反转录为cDNA,SYBR Premix EX Taq试剂盒用于cDNA的定量扩增,检测阿法替尼对A2780T细胞内ABCB1的编码基因MDR1 mRNA表达。MDR1基因特异性引物序列:5'-TGGGGCTGGACTTCCTCTCATGATGC-3'(上游引物)及5'-GCAGCAACCAGCACCCCAGCACCAAT-3'(下游引物);GAPDH特异性引物序列:5'-AGAAGGCTGGGGCTCATTTG-3'(上游引物)及5′-AGGGGCCATCCACAGTCTTC-3'(下游引物)。
1.3 统计学方法
采用SPSS13.0统计软件分析数据。数据以均数±标准差(x±s)表示,单因素方差比较组间数据的差异,P < 0. 05为差异有统计学意义。
2 结果
2.1 阿法替尼联用浓度的选择
化疗增敏实验中,通常选用对肿瘤细胞增殖抑制率不超10%的浓度作为化疗增敏剂在体外实验中的联用浓度,该浓度通常被认为是无毒浓度或低毒浓度。本实验中0.5 μmol/L的阿法替尼对A2780细胞的增殖抑制率为7.31%。阿法替尼与阿霉素联用于A2780细胞时选取的低、中、高浓度分别为0.125、0.25及0.50 μmol/L;2.5 μmol/L的阿法替尼对A2780T细胞的增殖抑制率为7.55%。阿法替尼与阿霉素联用于A2780T细胞时的低、中、高浓度分别选取为0.625、1.25及2.50 μmol/L,见图 1。
2.2 阿法替尼增强A2780T细胞对阿霉素的化疗敏感度
阿霉素对人卵巢癌A2780及A2780T细胞的IC50分别为(1.17±0.06)μmol/L及(27.69±2.11)μmol/L,表明A2780T细胞相较于A2780细胞对阿霉素高度耐药,可用于后续化疗增敏实验。阿法替尼可浓度依赖性降低阿霉素对A2780T细胞的IC50,即体外水平协同增敏耐药卵巢癌细胞A2780T对阿霉素的化疗敏感度。但阿法替尼不影响卵巢癌敏感株A2780对阿霉素的化疗敏感度。此外,经典的ABCB1转运体功能性抑制剂维拉帕米(10 μmol/L)同样可增敏A2780T细胞对阿霉素的化疗敏感度,提示阿法替尼可能是通过作用于ABCB1转运体发挥化疗增敏作用的,见表 1。
表 1 阿霉素与阿法替尼或维拉帕米联用对卵巢癌A2780及A2780T细胞的IC50值(x±s, 增敏倍数)Table 1 IC50 of adriamycin combined with afatinib or verapamil in human ovarian cancer A2780 and A2780T cell lines (x±s, sensitization folds)
2.3 ABCB1蛋白特异性siRNA可增强A2780T细胞对阿霉素的化疗敏感度
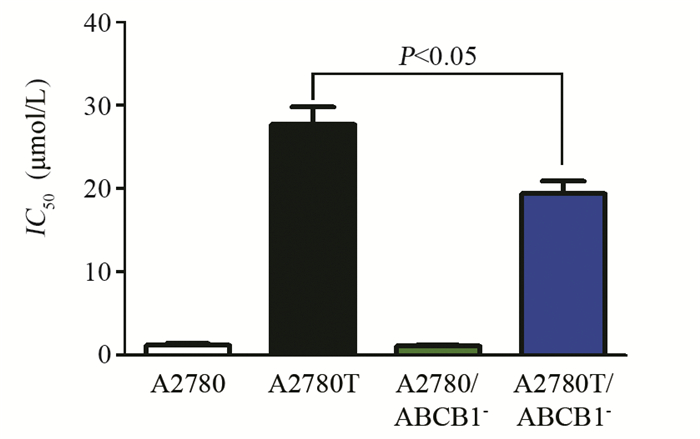
采用ABCB1特异性siRNA干扰卵巢癌细胞A2780及A2780T,得到其相应的ABCB1低表达细胞株(A2780/ABCB1¯, A2780T/ABCB1¯),见图 2。MTT实验发现,ABCB1特异性siRNA可显著降低阿霉素对耐药卵巢癌细胞A2780T的IC50,见图 3。阿法替尼可进一步降低阿霉素对A2780T/ABCB1¯细胞的IC50,提示阿法替尼可能是通过作用于ABCB1转运体进而发挥化疗增敏作用的,见表 2。
表 2 阿霉素与阿法替尼或维拉帕米联用前后卵巢癌A2780/ABCB1¯及A2780T/ABCB1¯细胞的IC50值(x±s, 增敏倍数)Table 2 IC50 of adriamycin combined with afatinib or verapamil in human ovarian cancer A2780/ABCB1¯and A2780T/ABCB1¯cell lines (x±s, sensitization folds)
2.4 阿法替尼对ABCB1转运体功能的影响
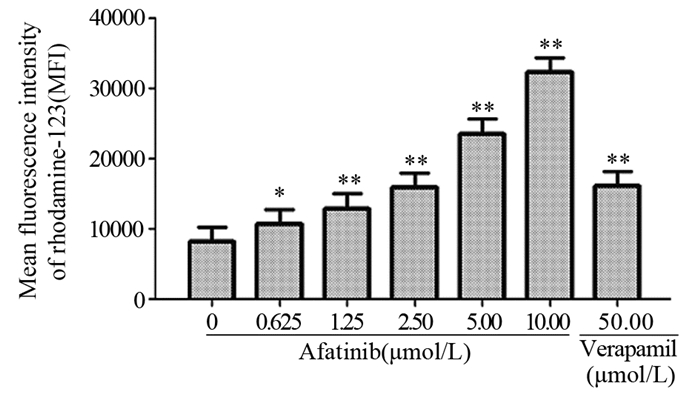
与ABCB1转运体的功能性抑制剂维拉帕米作用效果相似,阿法替尼可浓度依赖性地增加ABCB1转运体底物特异性荧光指示剂罗丹明123在卵巢癌A2780T细胞内的蓄积(P < 0.05),见图 4。鉴于ABCB1转运体在细胞膜主要发挥外排泵的作用,上述结果表明阿法替尼可能是通过抑制ABCB1转运体的外排功能发挥对阿霉素的化疗增敏作用的。
2.5 阿法替尼可激活ABCB1转运体的ATPase活性
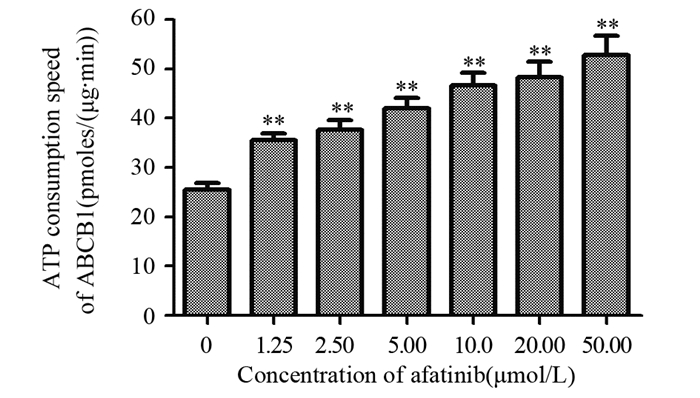
阿法替尼可浓度依赖性激活ABCB1转运体ATPase的活性,见图 5,表明阿法替尼可能是一种ABCB1转运体底物性药物,通过与阿霉素竞争性结合ABCB1转运体的底物结合位点,进而减少阿霉素的外排。
2.6 阿法替尼通过抑制A2780T细胞内MDR1基因转录进而下调ABCB1转运体的表达
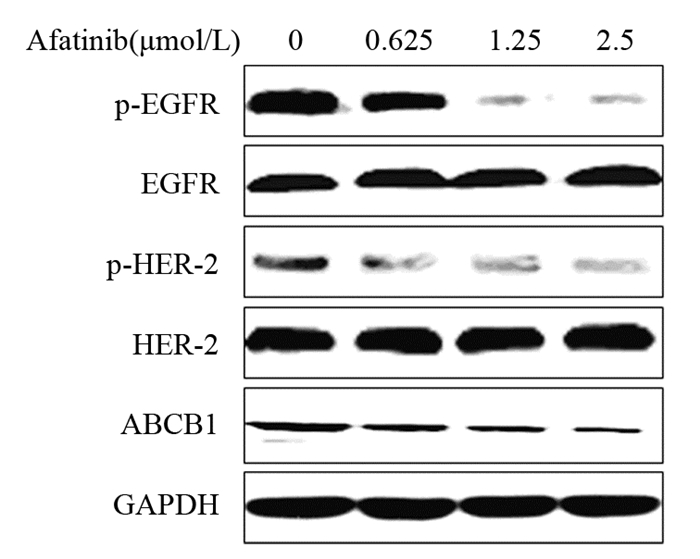
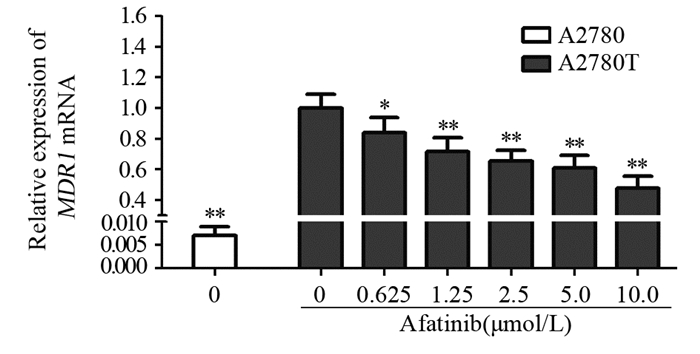
阿法替尼可抑制A2780T细胞内ABCB1转运体的表达,见图 6。进一步RT-PCR实验结果发现阿法替尼可浓度依赖性地下调A2780T细胞内MDR1 mRNA表达水平(P < 0.05),见图 7。阿法替尼可抑制A2780T细胞内EGFR及HER-2的磷酸化,而对EGFR及HER-2的总蛋白表达水平没有影响,见图 6。可见阿法替尼可通过抑制A2780T细胞内MDR1基因的转录进而下调ABCB1转运体的表达,发挥化疗增敏作用。
3 讨论
研究报道,表皮生长因子受体(EGFR)及人表皮生长因子受体2(HER-2)的异常表达和激活与多种恶性肿瘤的发生发展密切相关。阿法替尼是首个不可逆性TKIs[10],可与EGFR的Cys773位点及HER-2的Cys805位点共价结合,进而对这两个关键受体起到不可逆的抑制作用。这是阿法替尼的独特之处,也是第一代TKIs类药物所不具备的特性。第一代TKIs类药物如拉帕替尼、吉非替尼等可增强多药耐药肿瘤细胞化疗敏感度的报道较多,但不可逆性TKIs类药物阿法替尼的类似作用尚未见报道。本研究发现,与ABCB1转运体抑制剂维拉帕米作用效果相似,无毒浓度的阿法替尼即可显著增敏耐药性卵巢癌A2780T细胞对阿霉素的化疗敏感度。阿霉素是ABCB1转运体底物性药物,为检测阿法替尼增敏耐药性卵巢癌细胞化疗敏感度的作用与ABCB1转运体的相关性,本研究进一步采用ABCB1特异性的siRNA干扰ABCB1转运体的表达。MTT实验发现,敲低耐药卵巢癌A2780T细胞内ABCB1表达,可增加其对阿霉素的化疗敏感度,而联用阿法替尼可进一步增敏A2780T/ABCB1¯细胞对阿霉素的化疗敏感度。进一步研究发现阿法替尼可抑制ABCB1转运体底物性荧光指示剂罗丹明123在A2780T细胞内的蓄积量。证明阿法替尼增强了耐药性卵巢癌细胞对阿霉素化疗的敏感度,且该作用可能是通过抑制ABCB1转运体的外排功能实现的。
靶向作用于ABCB1转运体进而发挥对阿霉素化疗增敏作用既可通过抑制ABCB1转运体的外排功能“静态”实现,也可通过抑制ABCB1转运体的表达“动态”实现[11]。已有研究报道同样靶向于EGFR及HER-2双受体起效的可逆性TKIs拉帕替尼也可通过抑制ABCB1转运体的外排功能发挥对阿霉素的化疗增敏作用,但其不改变ABCB1转运体的表达[12]。本研究发现低毒浓度的阿法替尼可显著抑制耐药性卵巢癌A2780T细胞内ABCB1的编码基因MDR1的mRNA水平及ABCB1的蛋白水平,表明阿法替尼可通过下调耐药卵巢癌细胞中ABCB1转运体的表达,进而“动态”地发挥对阿霉素的化疗增敏作用。ABCB1转运体的外排过程是一个耗能过程,依赖ATP水解提供能量,由ABCB1转运的药物通常可激活其ATP酶活性[13]。本研究中阿法替尼可浓度依赖性激活ABCB1转运体的ATPase活性,表明阿法替尼可能是一种ABCB1转运体底物性药物,这一发现与TKIs多是ABCB1转运体底物药物的报道相符[13]。已有研究报道拉帕替尼作为ABCB1转运体的底物药物,长期使用可诱导ABCB1转运体的表达上调,降低联用的其他化疗药物的化疗效果[14]。故阿法替尼可下调ABCB1转运体表达的这一特点进一步凸显了阿法替尼靶向ABCB1转运体发挥化疗增敏作用的优势与潜力。
综上所述,阿法替尼不仅可通过竞争性抑制ABCB1转运体的功能,还可通过抑制ABCB1转运体的蛋白表达,增敏化疗药物阿霉素对耐药性卵巢癌细胞A2780T的效果,是一种有潜力的卵巢癌化疗增敏剂。
-
表 1 阿霉素与阿法替尼或维拉帕米联用对卵巢癌A2780及A2780T细胞的IC50值(x±s, 增敏倍数)
Table 1 IC50 of adriamycin combined with afatinib or verapamil in human ovarian cancer A2780 and A2780T cell lines (x±s, sensitization folds)

表 2 阿霉素与阿法替尼或维拉帕米联用前后卵巢癌A2780/ABCB1¯及A2780T/ABCB1¯细胞的IC50值(x±s, 增敏倍数)
Table 2 IC50 of adriamycin combined with afatinib or verapamil in human ovarian cancer A2780/ABCB1¯and A2780T/ABCB1¯cell lines (x±s, sensitization folds)

-
[1] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-32. doi: 10.3322/caac.21338
[2] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7-30. doi: 10.3322/caac.21332
[3] Jayson GC, Kohn EC, Kitchener HC, et al. Ovarian cancer[J].Lancet, 2014, 384(9951): 1376-88. doi: 10.1016/S0140-6736(13)62146-7
[4] Jagadeeshan S, David D, Jisha S, et al. Solanum nigrum Unripe fruit fraction attenuates Adriamycin resistance by down-regulating multi-drug resistance protein (Mdr)-1 through Jak-STAT pathway[J]. BMC Complement Altern Med, 2017, 17(1): 370. doi: 10.1186/s12906-017-1872-3
[5] Guo H, Liu Y, Wang Y, et al. pH-sensitive pullulan-based nanoparticle carrier for adriamycin to overcome drug-resistance of cancer cells[J]. Carbohydr Polym, 2014, 111: 908-17. doi: 10.1016/j.carbpol.2014.05.057
[6] Hurvitz SA, Shatsky R, Harbeck N. Afatinib in the treatment of breast cancer[J]. Expert Opin Investig Drugs, 2014, 23(7): 1039-47. doi: 10.1517/13543784.2014.924505
[7] Molife LR, Omlin A, Jones RJ, et al. Randomized Phase Ⅱ trial of nintedanib, afatinib and sequential combination in castration-resistant prostate cancer[J]. Future Oncol, 2014, 10(2): 219-31. doi: 10.2217/fon.13.250
[8] Seiwert TY, Fayette J, Cupissol D, et al. A randomized, phase Ⅱ study of afatinib versus cetuximab in metastatic or recurrent squamous cell carcinoma of the head and neck[J]. Ann Oncol, 2014, 25(9): 1813-20. doi: 10.1093/annonc/mdu216
[9] Shi Z, Liang YJ, Chen ZS, et al. Reversal of MDR1/P-glycoprotein-mediated multidrug resistance by vector-based RNA interference in vitro and in vivo[J]. Cancer Biol Ther, 2006, 5(1): 39-47. http://cn.bing.com/academic/profile?id=aac2037a9d2c19af360624f6532296a4&encoded=0&v=paper_preview&mkt=zh-cn
[10] Nam HJ, Kim HP, Yoon YK, et al. Antitumor activity of HM781-36B, an irreversible Pan-HER inhibitor, alone or in combination with cytotoxic chemotherapeutic agents in gastric cancer[J].Cancer Lett, 2011, 302(2): 155-65. doi: 10.1016/j.canlet.2011.01.010
[11] Tong XZ, Wang F, Liang S, et al. Apatinib (YN968D1) enhances the efficacy of conventional chemotherapeutical drugs in side population cells and ABCB1-overexpressing leukemia cells[J].Biochem Pharmacol, 2012, 83(5): 586-97. doi: 10.1016/j.bcp.2011.12.007
[12] Dai CL, Tiwari AK, Wu CP, et al. Lapatinib (Tykerb, GW572016) reverses multidrug resistance in cancer cells by inhibiting the activity of ATP-binding cassette subfamily B member 1 and G member 2[J]. Cancer Res, 2008, 68(19): 7905-14. doi: 10.1158/0008-5472.CAN-08-0499
[13] Liu KJ, He JH, Su XD, et al. Saracatinib (AZD0530) is a potent modulator of ABCB1-mediated multidrug resistance in vitro and in vivo[J]. Int J Cancer, 2013, 132(1): 224-35. doi: 10.1002/ijc.v132.1
[14] Dunne G, Breen L, Collins DM, et al. Modulation of P-gp expression by lapatinib[J]. Invest New Drugs, 2011, 29(6): 1284-93. doi: 10.1007/s10637-010-9482-7




 下载:
下载: