Role and Mechanism of miR-1269a on Targeted Regulation of HOXD10 in Invasion of Cholangiocarcinoma Cells
-
摘要:目的
探讨miR-1269a对HOXD10基因的调控作用及对胆管癌细胞侵袭能力的影响。
方法预测并筛选出调控HOXD10基因的miR-1269a作为研究对象; 转染miR-1269a模拟物(mimic)及抑制剂(inhibitor)至胆管癌细胞系后检测HOXD10mRNA及蛋白的表达变化, 并观察miR-1269a对胆管癌细胞侵袭能力的影响。双荧光素酶报告基因实验验证miR-1269a与HOXD10之间的靶向作用关系。
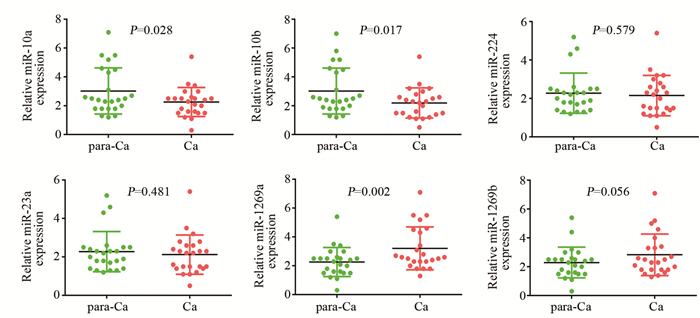
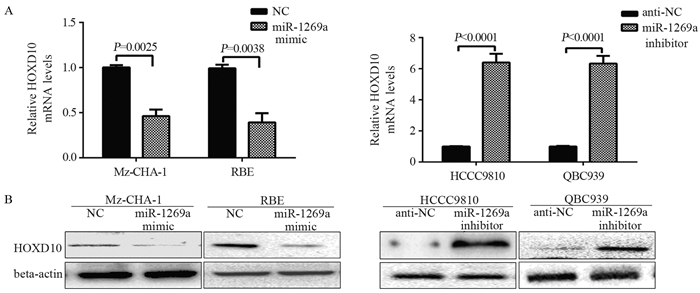
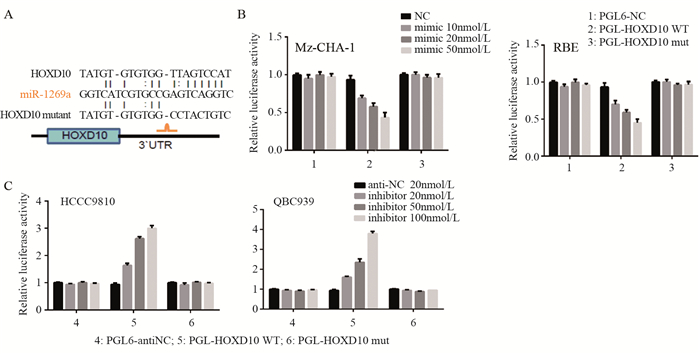
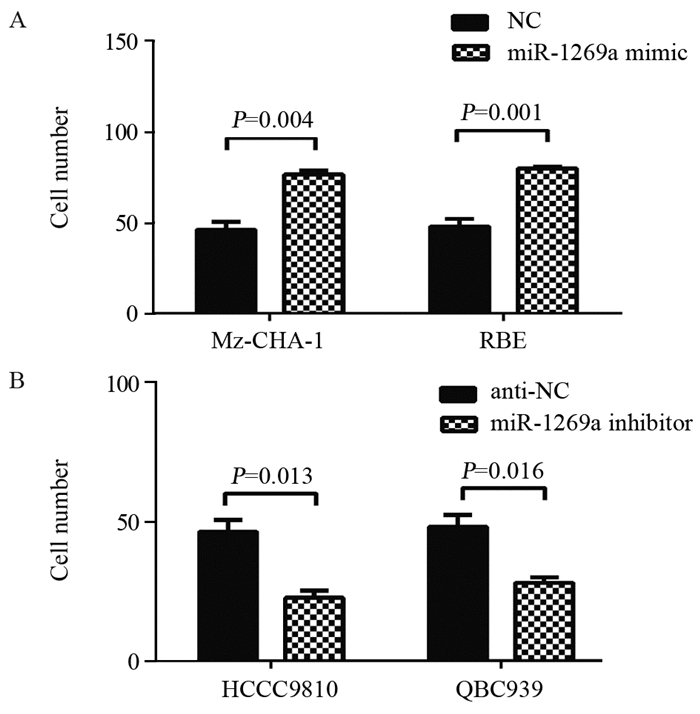
结果miR-1269a在胆管癌组织中表达显著高于癌旁组织(P=0.0023);miR-1269a模拟物可显著降低胆管癌细胞中HOXD10 mRNA(Mz-CHA-1:P=0.0025;RBE:P=0.0038)及蛋白表达水平, 且细胞的侵袭能力较对照组显著增强(Mz-CHA-1:P=0.004;RBE:P=0.004)。miR-1269a抑制剂转染则出现相反的结果(QBC939:P=0.16;HCCC9810:P=0.13)。miR-1269a明显抑制野生型HOXD10-3’UTR的荧光素酶活性, 而对突变型质粒转染细胞的荧光素酶活性无影响。
结论miR-1269a靶向负性调控HOXD10基因, 在胆管癌细胞侵袭过程中发挥重要作用。
Abstract:ObjectiveTo explore the possible mechanism of microRNA-1269a(miR-1269a) on the targeted regulation of HOXD10 in the invasion of human cholangiocarcinoma (CCC) cells.
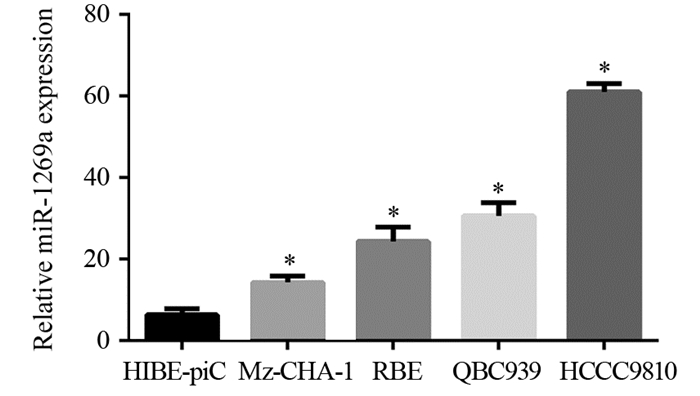
MethodsWe detected six miRNAs levels in human CCC samples and cells for screening miR-1269a as the research object.miR-1269a mimic and inhibitor were transfected into four CCC cells by Lipofectamine liposome respectively.The expressions of HOXD10 mRNA and protein were detected by real-time quantitative PCR (qPCR) and Western blot.The effect of miR-1269a on the invasion of CCC cells was observed.Double luciferase reporter assay was applied to verify the targeting relationship between miR-1269a and HOXD10.
ResultsmiR-1269a expression was significantly upregulated in CCC tissues, compared with adjacent normal tissues (P=0.0023).The mRNA and protein levels of HOXD10 in miR-1269a mimic transfection group were lower than those in control group (Mz-CHA-1:P=0.0025;RBE:P=0.0038).miR-1269a mimic significantly elevated the invasion capacity of CCC cells (Mz-CHA-1:P=0.004;RBE:P=0.004), while miR-1269a inhibitor remarkably inhibited the invasion (QBC939:P=0.16;HCCC9810:P=0.13).Double luciferase reporter gene test showed that miR-1269a could significantly inhibit the luciferase activity of wild-type HOXD10-3'UTR, but had no effect on the luciferase activity of mutant plasmid transfected cells.
ConclusionmiR-1269a may regulate the invasion of CCC cells by targeting HOXD10, and could be used as an effective target for the molecular therapy of CCC.
-
Key words:
- Cholangiocarcinoma(CCC) /
- miR-1269a /
- HOXD10(HomeoboxD10) /
- Invasion
-
0 引言
食管癌是常见的消化道疾病,为世界八大恶性肿瘤之一[1]。2012年间全世界范围内就有45.58万新增食管癌病例,死亡数40万人,东亚、非洲东部和南部是食管癌最严重地区[2]。目前食管癌治疗的主要方法仍然为外科手术[3]。高复发率仍然是一个亟待解决的问题。为此,越来越多的人趋向于多种疗法结合的策略,可将外科手术与化学疗法、放射疗法及放化疗法进行结合。在日本,用顺铂(CDDP)和5-氟尿嘧啶(5-Fu)进行化疗后再实施外科手术已经成为可切除食管癌的一种标准疗法[4]。对于不可切除的食管癌,化学疗法和放化疗法则成为标准治疗方案,目前被广泛认可的食管癌化学治疗药物仅有多烯紫杉醇(TxT)、CDDP和5-Fu[5]。因此,不论是可切除还是不可切除的食管癌,化学治疗药物都有着不可替代的作用,寻找更多的有效化学治疗药物对食管癌的治疗具有重要意义。芦荟是常见的多年生草本植物,易于种植。其用途十分广泛,在急性创伤、炎症反应、糖尿病、溃疡以及免疫调节等方面都发挥着积极作用[6]。本文就芦荟苷对食管鳞状细胞癌增殖、凋亡和侵袭进行了体外探讨,为发掘新的食管癌化疗药物提供理论参考。
1 材料与方法
1.1 细胞株和主要试剂
食管癌细胞系KESY70购自美国典型培养物保藏中心(American Type Culture Collection, ATCC)。RPMI 1640培养液和胎牛血清购自美国赛默飞世尔科技公司。芦荟苷购自美国Sigma公司,用DMSO进行溶解制成母液。Cell Counting Kit-8(CCK-8)购自日本同仁化学公司,细胞凋亡检测试剂盒Annexin V Apoptosis Detection Kit和Transwell小室及人工基底膜均购自美国BD公司。
1.2 细胞培养及药物处理
食管癌KESY70细胞培养于含10%胎牛血清和100 u/ml青-链霉素的RPMI 1640培养液中,并置于37℃、5%CO2的恒温培养箱中。食管癌KESY70细胞随机分为5组:未处理对照组(KESY70)、对照组(DMSO)和芦荟苷(10、40、80 μmol/L)组。
1.3 CCK-8检测细胞存活和增殖能力
食管癌细胞KESY70加入10、20、40、80和120 μmol/L的芦荟苷,添加DMSO为对照组。孵育24 h后,CCK-8法检测不同浓度下食管癌KESY70细胞的存活率。用10、40和80 μmol/L的芦荟苷处理食管癌KESY70细胞,分别于0、24、48、72和96 h检测细胞增殖倍数。
1.4 流式细胞术分析细胞凋亡
分别收集不同浓度(终浓度为:10、40和80 μmol/L)芦荟苷处理的细胞,制成1×106个每毫升的细胞悬液。FITC/PI染色15 min,利用流式细胞仪对染色的细胞进行检测,统计细胞凋亡率。
1.5 Transwell检测细胞侵袭能力
细胞悬浮于含1%胎牛血清的RPMI 1640培养液中并添加芦荟苷至终浓度为10、40和80 μmol/L,制成细胞密度为1×106个每毫升的细胞悬液。将细胞悬液加入到铺有人工基底膜的Transwell小室的上室中,下室加入含20%胎牛血清的RPMI 1640培养液。37℃、5%CO2的恒温培养箱中培养24 h后,0.5%的结晶紫染色后显微镜下观察细胞形态并随机选取5个视野统计细胞数量。
1.6 蛋白印迹法分析细胞增殖、凋亡和侵袭标记蛋白的表达
收集经芦荟苷处理的细胞,PBS洗3次后加入含蛋白酶抑制剂的细胞裂解液进行总蛋白的提取。然后进行SDS-PAGE凝胶电泳分离,再将蛋白转至PVDF膜。经5%的BSA封闭后,依次孵育相应的一抗和二抗,最后进行显色。统计灰度值计算相对表达量。
1.7 统计学方法
实验数据的统计学分析用SPSS16.0软件进行。两两比较用独立的t检验。P < 0.05为差异有统计学意义。
2 结果
2.1 芦荟苷对食管癌KESY70细胞活力的影响
加入10和20 μmol/L芦荟苷的食管癌细胞KESY70的存活率与DMSO组差异无统计学意义(P=0.623);当芦荟苷浓度达到40 μmol/L时,食管癌细胞KESY70的存活率降低更明显(P=0.036);芦荟苷浓度再增加至80和120 μmol/L时,食管癌细胞KESY70的存活率明显的降低(P=0.008),见图 1。可见,较低浓度的芦荟苷对食管癌KESY70细胞活力并无影响,但随着芦荟苷浓度的升高,食管癌细胞KESY70的活力也随之降低。
2.2 CCK-8法分析KESY70细胞增殖
低浓度(10 μmol/L)的芦荟苷不会影响KESY70的增殖能力;中浓度(40 μmol/L)的芦荟苷添加3 d后,KESY70细胞的增殖受到了明显抑制(P < 0.05);更高浓度(80 μmol/L)的芦荟苷作用3 d后,KESY70细胞增殖倍数显著低于DMSO组(P < 0.05),见图 2。表明当芦荟苷达到一定浓度时,食管癌细胞系KESY70的增殖能力会明显减弱,呈时间-剂量依赖性。
2.3 流式细胞术检测KESY70细胞凋亡
向食管癌细胞KESY70添加芦荟苷至终浓度为10、40和80 μmol/L,运用流式细胞术检测芦荟苷对KESY70细胞凋亡的影响。10 μmol/L的芦荟苷明显地增加KESY70细胞凋亡率(P < 0.05);40和80 μmol/L的芦荟苷十分显著地增加细胞凋亡率(P < 0.01),见图 3。由此可见,一定浓度的芦荟苷具有促进KESY70细胞凋亡的功能。
2.4 Transwell分析食管癌细胞KESY70侵袭能力
结晶紫染色后,通过显微镜下计数分析发现,10 μmol/L的芦荟苷明显地降低了KESY70细胞的侵袭能力(P < 0.05);40和80 μmol/L的芦荟苷则十分显著地降低了KESY70细胞的侵袭能力(P < 0.01),表明添加芦荟苷可以抑制食管癌细胞KESY70的侵袭能力,见图 4。
2.5 蛋白印迹法检测细胞增殖、凋亡和侵袭标记蛋白的表达
从蛋白印迹的结果图可以看出,芦荟苷可以抑制细胞增殖标记蛋白PCNA和侵袭标记蛋白MMP-9的表达;促进细胞凋亡标记蛋白Cleaved caspase-3的表达,见图 5A。与DMSO组相比,10和40 μmol/L加药组的细胞增殖标记蛋白PCNA的表达明显减弱(P < 0.05);80 μmol/L的表达显著降低(P < 0.01),见图 5B。10 μmol/L加药组细胞凋亡标记蛋白Cleaved caspase-3的表达明显高于DMSO组(P < 0.05);40和80 μmol/L的蛋白表达量明显升高(P < 0.01),见图 5C。加药组10、40和80 μmol/L的侵袭标记蛋白MMP-9的表达均降低,与DMSO组存在显著差异(P < 0.01),见图 5D。证明芦荟苷具有抑制食管癌细胞KESY70增殖和侵袭、促进细胞凋亡的作用。
3 讨论
细胞增殖的不受控是各类癌症的主要特征[7]。芦荟苷作为芦荟的有效药用成分之一,对多种癌症细胞的增殖具有一定的影响。有研究报道, > 140 μmol/L的芦荟苷还可以明显降低宫颈癌细胞HeLaS3的存活能力[8]。Ming-Chin等发现用150和200 μmol/L的芦荟苷处理肺癌细胞72 h后,细胞存活能力降低了50% [9]。本研究结果显示, > 40 μmol/L的芦荟苷处理食管癌细胞KYSE70会导致食管癌KYSE70细胞活力和增殖能力降低。
许多疾病中都会出现细胞凋亡的异常[10]。据报道芦荟苷在调节各类疾病的细胞凋亡方面发挥着积极作用。有数据显示芦荟苷可以促进结直肠癌细胞凋亡[11],还可诱导非小细胞肺癌A549细胞凋亡[12]。Wang等发现高分子纳米粒装载的芦荟苷可增强胃癌细胞凋亡[13]。本文结果显示, > 10 μmol/L的芦荟苷可有效促进食管癌细胞KYSE70的凋亡。
癌细胞的侵袭能力在癌症的发生发展进程中至关重要,越来越多的研究表明芦荟苷具有抑制癌细胞侵袭的功效。Pan等发现芦荟苷可减弱结直肠癌细胞的侵袭能力[11]。有数据显示,500 μmol/L的芦荟苷可以有效降低黑色素瘤细胞B16-F10的侵袭能力[14]。另外,芦荟苷处理还可减弱非小细胞肺癌细胞侵袭[15]。本研究检测了10、40和80 μmol/L芦荟苷对食管癌细胞KYSE70侵袭能力的影响,发现食管癌细胞KYSE70侵袭能力会随着芦荟苷浓度的升高而降低。
许多蛋白质在细胞增殖,凋亡及侵袭中起着重要的调控作用。如Ki67、PCNA、Caspase及MMPs等[16-18]。大量数据表明芦荟苷具有调控细胞增殖、凋亡及侵袭相关蛋白表达的功能。据报道芦荟苷可降低结肠癌中增殖相关蛋白PCNA的表达[19]。另外,芦荟苷处理非小细胞肺癌细胞后,凋亡相关蛋白Caspase-3、Caspase-8和Caspase-9表达上升,侵袭相关蛋白VEGF、MMP-9和MMP-14表达下降[15]。本研究结果显示,芦荟苷可减弱食管癌KYSE70细胞增殖相关蛋白PCNA和侵袭相关蛋白MMP-9表达,增强凋亡相关蛋白caspase-3的表达。
本研究中,低浓度(10和20 μmol/L)的芦荟苷对食管癌KYSE70细胞的生存活力无影响,中高浓度(40、80和120 μmol/L)的芦荟苷则可以抑制食管癌KYSE70细胞活力。40和80 μmol/L的芦荟苷作用于食管癌KYSE70细胞72 h后,细胞增殖能力明显减弱。10、40和80 μmol/L的芦荟苷还可以促进食管癌KYSE70细胞凋亡,抑制细胞侵袭。
综上所述,体外研究表明芦荟苷可以抑制食管癌KYSE70细胞的增殖和侵袭,促进细胞凋亡。本研究仅在细胞层面进行了探索,为了更加深入研究芦荟苷在食管癌治疗中的作用,下一步,我们计划建立KYSE70荷瘤小鼠模型,探索芦荟苷在体内对食管癌细胞增殖和迁移的影响及相应的信号通路,为新一代的食管癌抗癌药物的开发提供理论依据。
-
-
[1] Cheung AC, Lorenzo Pisarello MJ, LaRusso NF.Pathobiology of biliary epithelia[J].Biochim Biophys Acta, 2018, 1864(4 Pt B):1220-31. doi: 10.1016-S0016-5085(97)70244-0/
[2] Razumilava N, Gores GJ.Cholangiocarcinoma[J].Lancet, 2014, 383(9935):2168-79. doi: 10.1016/S0140-6736(13)61903-0
[3] Yang H, Zhou J, Mi J, et al.HOXD10 acts as a tumor-suppressive factor via inhibition of the RHOC/AKT/MAPK pathway in human cholangiocellular carcinoma[J].Oncol Rep, 2015, 34(4):1681-91. doi: 10.3892/or.2015.4194
[4] Ou Y, Zhang Q, Tang Y, et al.DNA methylation enzyme inhibitor RG108 suppresses the radioresistance of esophageal cancer[J].Oncol Rep, 2018, 39(3):993-1002. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=84d31284a5e6c44ea1daf388ace92f53
[5] Zhang Y, Yang P, Sun T, et al.miR-126 and miR-126* repress recruitment of mesenchymal stem cells and inflammatory monocytes to inhibit breast cancer metastasis[J].Nat Cell Biol, 2013, 15(3):284-94. doi: 10.1038/ncb2690
[6] Olaizola P, Lee-Law PY, Arbelaiz A, et al.MicroRNAs and extracellular vesicles in cholangiopathies[J].Biochim Biophys Acta, 2018, 1864(4 Pt B):1293-307. https://linkinghub.elsevier.com/retrieve/pii/S0925443917302247
[7] Ma L, Teruya-Feldstein J, Weinberg RA.Tumour invasion and metastasis initiated by microRNA-10b in breast cancer[J].Nature, 2007, 449(7163):682-8. doi: 10.1038/nature06174
[8] Li Q, Ding C, Chen C, et al.miR-224 promotion of cell migration and invasion by targeting Homeobox D 10 gene in human hepatocellular carcinoma[J].J Gastroenterol Hepatol, 2014, 29(4):835-42. doi: 10.1111/jgh.2014.29.issue-4
[9] Bu P, Wang L, Chen KY, et al.miR-1269 promotes metastasis and forms a positive feedback loop with TGF-beta[J].Nat Commun, 2015, 6:6879. doi: 10.1038/ncomms7879
[10] Hu X, Chen D, Cui Y, et al.Targeting microRNA-23a to inhibit glioma cell invasion via HOXD10[J].Sci Rep, 2013, 3:3423. doi: 10.1038/srep03423
[11] Yang H, Liang J, Zhou J, et al.Knockdown of RHOC by shRNA suppresses invasion and migration of cholangiocellular carcinoma cells via inhibition of MMP2, MMP3, MMP9 and epithelial-mesenchymal transition[J].Mol Med Rep, 2016, 13(6):5255-61. doi: 10.3892/mmr.2016.5170
[12] Yang H, Lu X, Liu Z, et al.FBXW7 suppresses epithelial-mesenchymal transition, stemness and metastatic potential of cholangiocarcinoma cells[J].Oncotarget, 2015, 6(8):6310-25. http://pubmedcentralcanada.ca/pmcc/articles/PMC4467439/
[13] Huang M, Su L, Yang L, et al.Effect of exogenous TGF-beta1 on the cadmium-induced nephrotoxicity by inhibiting apoptosis of proximal tubular cells through PI3K-AKT-mTOR signaling pathway[J].Chem Biol Interact, 2017, 269:25-32. doi: 10.1016/j.cbi.2017.03.010
[14] Ko DY, Shin JM, Um JY, et al.Rapamycin inhibits transforming growth factor beta 1 induced myofibroblast differentiation via the phosphorylated-phosphatidylinositol 3-kinase mammalian target of rapamycin signal pathways in nasal polyp-derived fibroblasts[J].Am J Rhinol Allergy, 2016, 30(6):211-7. doi: 10.2500/ajra.2016.30.4389
[15] Luo D, Hu S, Tang C, et al.Mesenchymal stem cells promote cell invasion and migration and autophagy-induced epithelial-mesenchymal transition in A549 lung adenocarcinoma cells[J].Cell Biochem Funct, 2018, 36(2):88-94. doi: 10.1002/cbf.v36.2
[16] Zhong W, Tong Y, Li Y, et al.Mesenchymal stem cells in inflammatory microenvironment potently promote metastatic growth of cholangiocarcinoma via activating Akt/NF-κB signaling by paracrine CCL5[J].Oncotarget, 2017, 8(43):73693-704 http://pubmedcentralcanada.ca/pmcc/articles/PMC5650292/
[17] Patman G.Liver cancer:TGF-β and cholangiocarcinoma[J].Nat Rev Gastroenterol Hepatol, 2016, 13(1):2-3. http://d.old.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0225747915/
[18] Wang H, Li C, Jian Z, et al.TGF-β1 Reduces miR-29a Expression to Promote Tumorigenicity and Metastasis of Cholangiocarcinoma by Targeting HDAC4[J].PLoS One, 2015, 10(10):e0136703. doi: 10.1371/journal.pone.0136703
[19] Chen Y, Ma L, He Q, et al.TGF-β1 expression is associated with invasion and metastasis of intrahepatic cholangiocarcinoma[J].Biol Res, 2015, 48:26. doi: 10.1186/s40659-015-0016-9




 下载:
下载: