Effects of TET1 on Proliferation and Invasion of Human Breast Cancer MDA-MB-231 Cells and Related Mechanism
-
摘要:目的
探讨TET1对乳腺癌MDA-MB-231细胞增殖、转移、侵袭等生物学行为的影响,并初步探究其相关分子机制。
方法应用慢病毒载体建立TET1过表达稳转细胞株(MDA-MB-231-TET1)及阴性对照组稳转细胞株(MDA-MB-231-NC),Real-time PCR及Western blot法检测TET1的表达情况。CCK-8法、流式细胞术检测细胞的增殖及细胞周期分布,细胞划痕实验及Transwell小室检测细胞迁移及侵袭能力;Western blot及免疫荧光实验检测EMT相关蛋白(E-cadherin、N-cadherin、Vimentin、β-catenin)分子的表达。
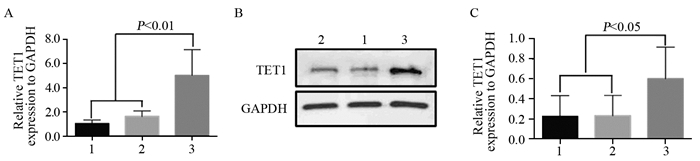
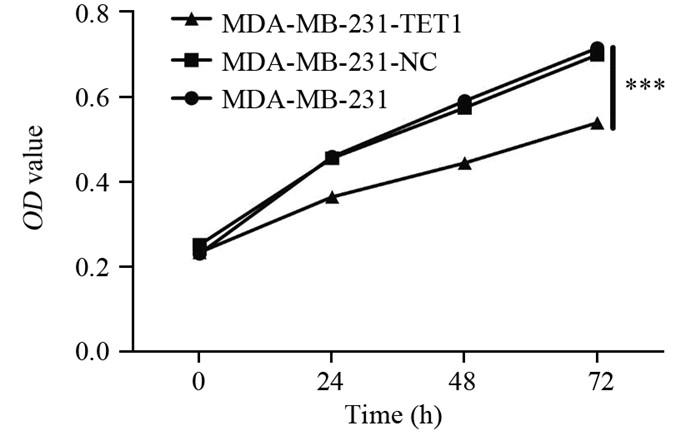
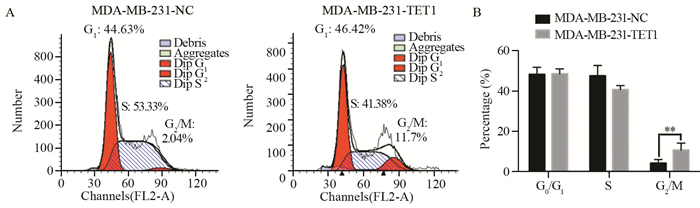
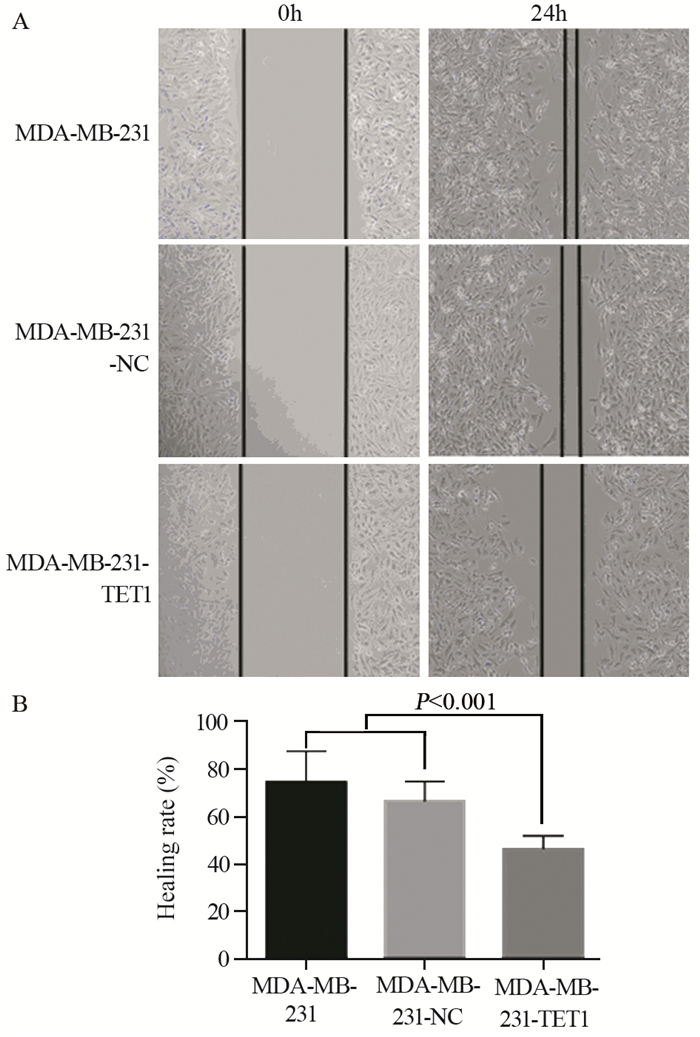
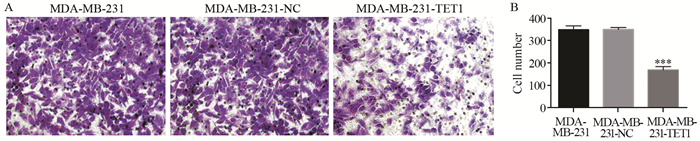
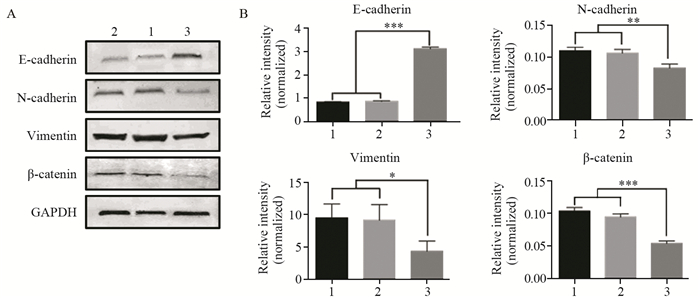
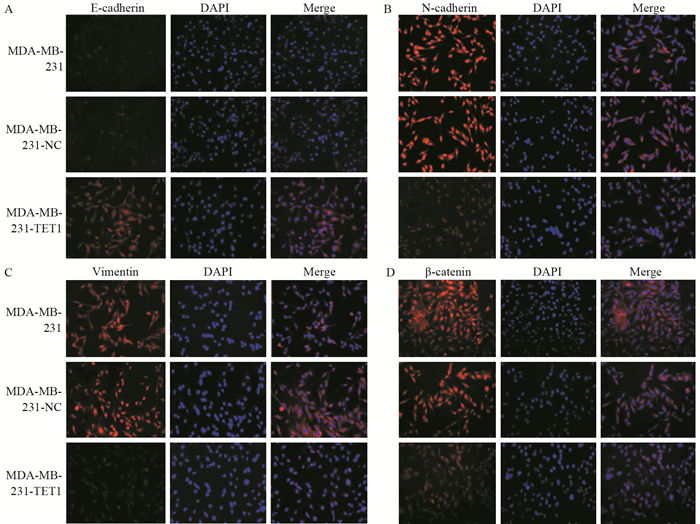
结果成功构建过表达TET1细胞株(P=0.03)。相较于阴性对照组和空白对照组细胞,MDA-MB-231-TET1组细胞增殖、迁移及侵袭明显受到抑制(P < 0.001),G2/M期细胞周期阻滞(P=0.002);同时,伴随E-cadherin表达升高(P < 0.001),N-cadherin(P=0.003)、Vimentin(P=0.041)表达降低,β-catenin(P < 0.001)表达降低,并且TET1可抑制β-catenin向细胞核内转移,进而抑制EMT的发生。
结论TET1可抑制MDA-MB-231细胞增殖,并能抑制其迁移及侵袭,其机制可能与通过Wnt/β-catenin通路抑制EMT的发生相关。
Abstract:ObjectiveTo investigate the effects of ten-eleven translocation (TET1) on the proliferation, metastasis and invasion of breast cancer MDA-MB-231 cells and possible mechanisms.
MethodsBreast cancer cell line MDA-MB-231 were stably transfected with recombinant lentiviral expression vector of TET1 and enhanced green fluorescent protein (eGFP). The mRNA and protein expressions of TET1 were detected by Real-time PCR and Western blot. Cell proliferation was detected by CCK-8 assay and flow cytometry was adopted to determine cell cycle distribution. The migration and invasion abilities of cells were detected by wound healing assay and transwell assay. The expression levels of EMT-related protein, such as E-cadherin, N-cadherin, Vimentin and β-catenin, were measured by Western blot and immunofluorescence.
ResultsA stable overexpression of TET1 cell line was successfully obtained (P=0.030). Cell proliferation, migration and invasion abilities were significantly decreased in MDA-MB-231-TET1 cells(P < 0.001), compared with control group. The overexpression of TET1 suppressed cell proliferation through inducing G2/M arrest (P=0.002). At the same time, the level of E-cadherin was significantly increased(P < 0.001) and N-cadherin, Vimentin, and β-catenin were decreased(P=0.003, P=0.041, P < 0.001) in MDA-MB-231-TET1 cells. TET1 inhibited the nuclear translocation of β-cantenin and then repressed EMT.
ConclusionThe overexpression of TET1 suppresses the proliferation, migration and invasion abilities of MDA-MB-231 cells by inducing EMT through regulating Wnt/β-catenin pathway in vitro.
-
Key words:
- TET1 /
- Breast cancer /
- Proliferation /
- Invasion /
- Epithelial mesenchymal transition
-
0 引言
肝细胞癌(hepatocellular carcinoma, HCC)是世界上最常见的癌症之一,其发病率、病死率和死亡率在全球呈上升趋势,癌症负担较重[1]。HCC的局部治疗可以有效治疗局部病变,但不能使残留的癌细胞完全清除,也无法杜绝肿瘤的复发与转移。
2007年,美国食品药品监督管理局(FDA)批准索拉非尼用于不可切除的肝细胞癌(unresectable hepatocellular carcinoma, uHCC)患者的全身治疗,这是肝癌第一个获批的靶向治疗药物,Ⅲ期临床试验数据显示索拉非尼延长了晚期肝癌患者的生存期,但其客观缓解率(ORR)仅2%,疗效并不十分突出[2]。从2017年开始,FDA陆续批准了其他靶向药物如Lenvatinib、Regorafenib、Cabozantinib和Ramucirumab等用于一线或二线治疗HCC,但其疗效和安全性仍未达满意,肝癌治疗迫切需要新方法。
免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)的出现显著改善了客观缓解率和生存率,HCC的免疫治疗逐渐进入人们的视野。目前HCC的免疫治疗主要包括ICIs治疗、过继细胞疗法(adoptive cell therapy, ACT)、靶向肝癌的肿瘤相关抗原的抗体治疗和肿瘤疫苗等。本文将对目前肝细胞癌ICIs单药及联合治疗的研究进展作一综述,并讨论目前免疫治疗发展的限制以及未来发展方向。
1 肝细胞癌的免疫微环境及免疫调节靶点
HCC的发生与发展存在多种机制。一方面,肝脏炎性反应会导致肝细胞受损,从而促进免疫耐受,使肝细胞逃避免疫监视。另一方面,复杂的肿瘤微环境(TME)也可介导HCC免疫耐受和免疫逃避[3]。肝癌TME中存在很多免疫调节靶点,既有细胞相关,也有可溶性分子,对这些靶点的研究可进一步明确免疫治疗的机制,从而发掘更多靶点治疗药物并改善治疗效果和安全性。
免疫检查点是其中一种免疫调节靶点,它是指程序性死亡受体及其配体。肝癌研究中常见的免疫检查点包括PD-1及其PD-L1,细胞毒性T淋巴细胞蛋白4(CTLA-4),以及T细胞免疫球蛋白及黏蛋白结构域分子3(T cell immunoglobulin and mucin domain-3, TIM-3)和淋巴细胞活化基因3蛋白(lymphocyte activation gene-3, LAG-3)等。ICIs通过抑制程序性死亡受体及其配体结合而提高抗肿瘤活性。
2 免疫检查点抑制剂单药治疗在肝细胞癌中的研究进展
2.1 PD-1/PD-L1抑制剂
2.1.1 Nivolumab
Nivolumab是一种PD-1抑制剂。一项关于Nivolumab治疗晚期HCC的试验(CHECKMATE 040)研究结果表明Nivolumab在剂量递增期的ORR为15%,患者对Nivolumab的中位反应持续时间为17个月(95%CI: 6~24),反应者的2年生存率超过80%,并且显示出良好的安全性和耐受性[4]。基于以上试验结果,2017年9月,FDA批准Nivolumab为肝癌索拉非尼之后的二线用药,是首个FDA批准的肝癌ICIs。为探索Nivolumab在晚期HCC患者中作为一线用药的可能性,实施了一项Ⅲ期试验(CheckMate 459)[5]。Nivolumab一线治疗与索拉非尼相比并没有明显提高总体存活率,但在晚期HCC患者中观察到了临床活性和良好的安全性,Nivolumab对疾病控制更持久,不良事件发生也更少。因此对酪氨酸激酶抑制剂和抗血管生成药物存在禁忌证或有很大风险的患者,Nivolumab可能是一种治疗选择。
2.1.2 Pembrolizumab
Pembrolizumab是一种PD-1抑制剂。一项Ⅲ期试验(Keynote-240)评估Pembrolizumab在晚期肝癌患者中的疗效和安全性,试验结果显示存活率显著延长(风险比率0.78, P=0.023),且根据无进展生存时间和总体生存曲线,一些患者从Pembrolizumab治疗中获得了长期益处(Pembrolizumab组的ORR为18.3%(95%CI: 14.0~23.4)明显优于对照组(ORR为4.4%, 95%CI: 1.6~9.4),但是未达到指定标准的统计学意义[6]。研究期间,Regorafenib和Nivolumab获批成为肝癌的二线治疗用药,本次试验的统计学阴性结果可能与此有关。该试验的结果与Ⅱ期试验Keynote-224的结果一致。在试验Keynote-224中,对确诊肝细胞癌且经索拉非尼治疗后出现进展或不耐受的成年患者使用Pembrolizumab治疗后,进行疗效和安全性评估,经过约2.5年的随访,数据显示Pembrolizumab能够提供持久的抗肿瘤活性,并且没有发现新的安全问题[7]。
2.1.3 Tislelizumab
Tislelizumab是一种PD-1单克隆抗体。在Ⅰa/Ⅰb期试验中,Tislelizumab显示出在晚期实体肿瘤患者中具有抗肿瘤活性的证据,Ⅱ期试验RATIONALE-208和Ⅲ期试验RATIONALE-301正在进行中,主要目的分别是研究其在肝癌患者中二线治疗和一线治疗的疗效及安全性,其结果可能有助于完善uHCC一线治疗的需求。
2.1.4 Camrelizumab
Camrelizumab是一种完全人源化的抗PD-1 IgG4单克隆抗体。Ⅱ期试验(SHR-1210-Ⅱ/Ⅲ-HCC)结果表明经过预处理晚期肝癌患者对Camrelizumab有持久反应且生存期较长,通过长期随访,Camrelizumab继续显示出晚期肝癌患者的持久反应和较长的存活期。这表明Camrelizumab单一疗法在二线或更晚的情况下可能成为晚期肝癌的一种治疗选择[8]。这些研究结果进一步证实,Camrelizumab单一疗法在二线或更晚的情况下可能是晚期肝癌的一种有价值的治疗选择。
2.1.5 PD-L1抑制剂
目前,PD-L1抑制剂主要有Atezolizumab、Durvalumab等。Durvalumab治疗uHCC患者的Ⅰ/Ⅱ期试验(D4190C00022)结果显示ORR为10%,中位生存期为13.2个月[9]。
2.2 CTLA-4阻断剂和其他
CTLA-4阻断剂目前主要有Ipilimumab和Tremelimumab用于肝癌治疗。FDA已于2011年批准Ipilimumab用于晚期黑色素瘤的治疗,2020年批准Nivolumab联合Ipilimumab用于二线治疗HCC。对TIM-3、LAG-3和其他免疫检查点的研究,可能有助于探索这些ICIs联合PD-1/PD-L1抑制剂治疗HCC。
3 免疫检查点抑制剂与其他疗法联合治疗在肝细胞癌中的研究进展
单药免疫疗法为治疗HCC创造了新机会,但是单药治疗未能获得较为满意的临床结果,且显示出一些局限性。主要表现为两个方面:一是肝癌的TME复杂,其免疫耐受性较高;二是单药治疗通常有比较明显的剂量依赖性不良反应,如胃肠道反应、皮疹等。因此联合治疗正在成为肝癌免疫治疗研究的重要方向。
3.1 双ICIs联合
在随机临床试验CHECKMATE 040中,Nivolumab(抗PD-1)联合Ipilimumab(抗CTLA-4)的治疗方案具有可控的安全性、良好的客观反应率和持久反应,中位总生存期为22.8个月[10]。其中Ipilimumab起始量较高的A组方案(4剂Nivolumab 1 mg/kg加Ipilimumab 3 mg/kg,每3周一次,然后Nivolumab 240 mg每2周一次)效果最佳。基于以上试验结果,FDA批准了Nivolumab加Ipilimumab联合疗法二线治疗HCC患者,此种联合疗法是FDA批准的首个也是目前唯一一个针对肝癌患者的双ICIs疗法。然而同时A组患者报告的免疫相关不良事件和因药物毒性作用而停药的发生率最高,但大多数可控。为探索该疗法作为肝癌患者一线治疗的可能性,临床试验CheckMate 9DW正在进行中。
为评估Durvalumab(抗PD-L1)和Tremelimumab(抗CTLA-4)作为单一疗法和联合疗法治疗uHCC的效果,实施了一项Ⅰ/Ⅱ期试验(D4190C00022),该试验共设置四种方案,均显示临床有效,其中T300+D(即Tremelimumab 300 mg加durvalumab 1 500 mg(第一周期各一剂),随后Durvalumab 1 500 mg,每4周一次)这一方案显示出最大的疗效(ORR为24%),具有更好的安全性和更持久的反应,而且具有独特的T细胞增殖反应[9]。目前该疗法作为晚期HCC患者一线治疗的研究(D419CC00002)正在进行中。
随着更多临床试验的展开、更多临床数据的获得,ICIs之间的组合策略显示出突出的疗效,但与此同时的代价是更明显的不良反应。目前,这种双ICIs联合疗法的发展集中在新辅助治疗或作为放疗或经导管动脉化学栓塞后的辅助治疗。双免疫联合治疗可能成为晚期HCC患者治疗的重要手段。
3.2 ICIs联合靶向药物
3.2.1 ICIs联合血管内皮生长因子(VEGF)抑制剂
全球性Ⅲ期临床试验IMbrave150旨在确定Atezolizumab(又名Tecentriq,抗PD-L1)联合Bevacizumab(又名Avastin,单靶点VEGF抑制剂)(简称“T+A”疗法)与索拉非尼相比,在既往未接受全身治疗的uHCC患者中的安全性和有效性。研究共纳入501例既往未接受过系统治疗的uHCC患者,按照2:1随机分组,分别接受“T+A”治疗或索拉非尼治疗。“T+A”组中位总生存期达19.2个月,死亡风险较索拉非尼对照组降低42%,疾病进展风险降低41%,客观缓解率达30%。在中国亚组扩展试验中,“T+A”组中133例中国患者中位总生存期达到24.0个月。该结果表明该联合治疗方案显著优于索拉非尼对照组[11]。基于以上结果,FDA于2020年5月批准此种联合疗法用于一线治疗uHCC。该疗法是FDA批准的首个也是目前唯一一个用于HCC一线治疗的免疫疗法,这一突破标志着晚期HCC治疗标准的重要变化。除此之外,该试验还以调查问卷的形式收集患者的治疗体验,主要包括生活质量、功能和疾病症状等,数据分析显示,联合治疗组比索拉非尼组在以上这些方面有更显著的临床益处。然而该试验是在保留肝功能(Child-Pugh A级)和食管胃底静脉曲张破裂出血风险降低的患者群体中展开的,此方案值得在更广泛的人群中进行进一步研究。与此同时,与索拉非尼组(48例患者(30.8%))相比,Atezolizumab+Bevacizumab联合组(125例患者(38.0%))发生严重不良事件的频率更高。因此,在提高疗效的同时,如何管理不良事件是联合治疗需要面临的重大问题。总之,“T+A”联合策略具有极大潜力和优势,目前诸多该疗法与其他治疗方法的联合研究正在进行中,包括与肝癌切除术、90钇微球肝动脉放射栓塞术等联合,以“T+A”为代表的免疫联合方案将为更多肝癌患者带来更长且更好的生存可能[12-13]。
IBI305是一种单靶点Bevacizumab生物类似药。一项Sintilimab联合IBI305用于uHCC一线治疗的研究(ORIENT-32)在中国人群中展开,结果显示与索拉非尼组患者(2.8个月,95%CI: 2.7~3.2)相比,Sintilimab组患者的中位无进展生存期(4.6个月,95%CI: 4.1~5.7)和总生存期显著延长[14]。这种联合治疗方案可以为这类患者提供新的治疗选择。
3.2.2 ICIs联合酪氨酸激酶抑制剂
一些酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKIs)已用于肝癌的一线和二线治疗,但由于不良反应和耐药性的限制,单药的安全性和疗效有待改善,这使得与免疫治疗的联合成为可能。近年来ICIs与TKIs的联合策略正成为HCC治疗研究的热点方向。
2018年8月FDA批准多靶点酪氨酸激酶抑制剂乐伐替尼(Lenvatinib)用于不可切除晚期HCC患者的一线治疗。Lenvatinib(TKI)联合Pembrolizumab(抗PD-1)治疗uHCC的试验(KEYNOTE-524)结果显示其ORR为46%,中位无进展生存时间为9.3个月,中位总体生存期为22.0个月[15]。试验结果表明两者的联合使用可以提高抗肿瘤活性,而且通过监测、剂量调整或中断治疗可以控制这种联合疗法的不良反应。关于两者的联合治疗方案作为uHCC一线治疗药物的试验研究LEAP-002,将进一步评估这种疗法在uHCC患者中的安全性和有效性。这种方案可能成为一种新的治疗选择。
2019年1月FDA批准卡博替尼(Cabozantinib)用于HCC二线治疗,Cabozantinib是一种多靶点的小分子酪氨酸激酶抑制剂。Ⅲ期试验COSMIC-312研究将评估Cabozantinib(TKI)联合Atezolizumab(抗PD-L1)用于一线治疗晚期HCC患者的疗效和安全性[16]。该试验将740位患者随机分为三组:Cabozantinib+Atezolizumab(370例)、索拉非尼单药(185例)及Cabozantinib单药(185例)。联合组口服Cabozantinib 40 mg,1次/天,同时静脉滴注Atezolizumab 1 200 mg,每3周一次。目前该临床试验正在进行中。此外,试验CHECKMATE 040结果显示,与单药Nivolumab相比,Cabozantinib联合Nivolumab客观反应率提高了一倍,而且生存期延长,但是与此同时不良反应也更频繁、严重[17]。
Camrelizumab(抗PD-1)联合Apatinib(TKI)治疗晚期原发性肝癌的回顾性研究(SHR-1210-APTN-II-203-PLC)结果显示ORR为10.7%,中位无进展生存期和总生存期分别为3.7个月和13.2个月,表明这种联合方案对晚期原发性肝癌患者具有可控的毒性和良好的抗肿瘤活性[18]。Camrelizumab联合索拉非尼治疗晚期肝癌,与索拉非尼单独治疗相比,联合治疗的方案有更长的无进展生存时间、更高的ORR[19],需要进一步的前瞻性研究来支持这一初步发现。2022年10月将此种联合治疗方案向FDA提交申请。
既往晚期HCC的相关临床研究,无论是靶向药物还是免疫检查点抑制剂单药治疗,其客观缓解率均较低,早期的靶向药物仅为2%~3%左右,而目前靶向免疫联合治疗使客观缓解率显著提高,可达30%~40%甚至更高,这个结果令人非常兴奋。总之,靶向免疫联合达到了“1+1 > 2”的效果,打破了十余年来晚期HCC治疗效果没有突破的现状,可能会革命性地改变晚期HCC治疗模式。
3.3 ICIs联合局部治疗
射频消融(radiofrequency ablation, RFA)、放疗和经动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)等是HCC的局部治疗方法。越来越多的证据支持RFA与免疫治疗的联合策略可能有利于提高治疗效果、降低肝癌复发率。一方面,在HCC射频消融后观察到局部炎性反应因子和新抗原的释放,多种肿瘤相关抗原的特异性T细胞反应增强,但是不足以完全阻止肝癌复发[20];另一方面,免疫治疗的加入可能协同放大抗肿瘤免疫反应。肝癌患者接受Tremelimumab(抗CTLA-4)直到达到停药标准,在第36天时,接受RFA或者TACE进行部分肿瘤消融,结果显示疾病控制率为89%,ORR为26%,其中45%的稳定持续时间超过6个月,总生存期为12.3个月[21]。这些有利数据推动了相关临床试验,使ICIs与局部治疗的联合策略得到进一步研究。
目前,消融治疗的最佳频率、免疫治疗加入的最佳时间等问题尚待完善。此外,消融免疫的组合策略多种多样,不同组合之间的差异尚未厘清,需要更多临床试验加以支持。
4 ICIs的不良事件及管理
ICIs可能会引起自我耐受性受损,这是造成免疫相关不良事件(immune-related adverse events, irAEs)的常见原因。PD-1/PD-L1抑制剂引起的irAEs最常见的靶器官是皮肤(皮疹11%、瘙痒10%)、胃肠道(腹泻11%)和甲状腺(甲状腺功能减退7%)[22];CTLA-4抑制剂引起的irAEs最常见的靶器官是皮肤(44%)和胃肠道(35%)[23]。免疫介导的肝炎(immune mediated hepatitis, IMH)是重要不良事件之一,临床上主要表现为丙氨酸氨基转移酶(ALT)和(或)天门冬氨酸氨基转移酶(AST)无症状升高。PD-1/PD-L1抑制剂引起IMH发生率为5%,CTLA-4抑制剂发生率小于10%,联合用药时发生率可达33%[24]。按照规范的分级治疗,大多数患者预后良好,极少数发生肝衰竭死亡。当这些irAEs产生时,通过及时停药、单独使用皮质类固醇以及联合硫唑嘌呤或霉酚酸酯等方法大多可有效处理。我国因感染乙肝病毒而罹患肝细胞癌的患者占有很大比例,关注此类患者特殊的不良事件很有必要。乙肝表面抗原(HBsAg)阳性患者可能会在使用ICIs时出现乙肝病毒(HBV)的再激活风险,接受预防性抗病毒治疗可有效降低该风险[25]。
在接受ICIs治疗的晚期HCC患者中,irAEs的存在能预测更好的反应和生存结果。尤其是低级别irAEs,可能是预测HCC患者ICIs疗效的有效因素[26]。通过上文各临床试验结果对比分析不难发现,联合治疗比单药治疗带来的不良事件发生率更高,但同时带来的机会也更多,因此不良反应在某种程度上同时意味着更多的获益。
5 ICIs应用的限制因素
目前HCC死亡率仍然很高,一部分原因是由于未能早期发现导致诊断时已至肝癌晚期。专业学会建议对慢性肝病高危患者半年进行一次HCC筛查,来增加治愈的可能性并提高生存率。随着基因测序的改进和生物信息学的发展,敏感生物标志物的挖掘变得普遍,或可以成为筛查的重要手段。目前生物标志物主要包括三种类型:非侵入性血清生物标志物、肝脏组织生物标志物和放射生物标志物等。这些生物标志物的动态评估对于选择合适的疗法和评估治疗反应、肿瘤进展、耐药性和癌症复发具有重要作用。除了传统的甲胎蛋白AFP以外,蛋白质生物标志物如PD-L1和ADAM9等可预测ICIs的治疗反应[27-28];组织生物标志物如GPC3和Serglycin等可预测晚期HCC总生存期[29-30]。一项关于肠道微生物群与HCC抗PD-1免疫治疗反应之间的关系研究表明,肠道微生物群的动态变化特征可以为HCC的免疫治疗效果提供早期预测,具体机制尚不明确,需进一步研究[31]。然而目前预测ICIs治疗反应的生物标志物仍有很多限制,如探索和应用成本较高,以及分析平台和技术要求较高等。此外,大量生物标志物还未经过细胞、动物实验以及临床实际应用的验证,需要进一步的研究来验证生物标志物在HCC免疫治疗中的预测能力[32]。除此之外,大量HCC患者对ICIs药物产生了耐药性问题,导致这些患者并没有获得最终临床效益,因此耐药克服的研究对扩大ICIs受益患者的范围非常必要。目前,已经有很多学者对ICIs耐药机制展开研究,包括肿瘤耐药的内在及外在机制,这对克服耐药性有很大帮助。Petal等学者认为,联合治疗在一定程度上可以克服ICIs耐药性[33]。此外,将冷肿瘤转化为热肿瘤也是克服耐药性的一种策略。
6 总结与展望
近几年来,关于HCC免疫治疗的研究增多,并在一定程度上改变治疗标准。单一免疫治疗的缓解率和生存率不高,而联合治疗具有很大潜力,是未来免疫治疗发展的关键。然而目前免疫治疗还有很多限制尚待突破。对ICIs治疗反应的非侵入性生物标志物的研究需进一步探索,irAEs的合理管理和耐药性克服也有助于扩展免疫治疗的临床应用。未来,不仅需要提高已有疗法的有效性和安全性,还需进一步开发新的免疫治疗药物,如双特异性抗体、抗体-药物偶联物、过继细胞疗法和新抗原疫苗接种等。探索单药或联合治疗敏感度和耐药性的分子机制,以挖掘更有效的生物标志物,或许有助于推进个性化治疗。将ICIs与其他疗法联合有望改善晚期肝细胞癌的临床疗效。
-
-
[1] Jin C, Lu Y, Jelinek J, et al. TET1 is a maintenance DNA demethylase that prevents methylation spreading in differentiated cells[J]. Nucleic Acids Res, 2014, 42(11): 6956-71. doi: 10.1093/nar/gku372
[2] Zhao H, Chen T. Tet family of 5-methylcytosine dioxygenases in mammalian development[J]. J Hum Genet, 2013, 58(7): 421-7. doi: 10.1038/jhg.2013.63
[3] Tan L, Shi YG. Tet family proteins and 5-hydroxymethylcytosine in development and disease[J]. Development, 2012, 139(11): 1895-902. doi: 10.1242/dev.070771
[4] Cimmino L, Abdel-Wahab O, Levine RL, et al. TET family proteins and their role in stem cell differentiation and transformation[J]. Cell Stem Cell, 2011, 9(3): 193-204. doi: 10.1016/j.stem.2011.08.007
[5] Yang H, Liu Y, Bai F, et al. Tumor development is associated with decrease of TET gene expression and 5-methylcytosine hydroxylation[J]. Oncogene, 2013, 32(5): 663-9. doi: 10.1038/onc.2012.67
[6] Chen HF, Wu KJ. Epigenetics, TET proteins, and hypoxia in epithelial-mesenchymal transition and tumorigenesis[J]. BioMedicine(Taipei), 2016, 6(1): 1-8. doi: 10.7603/s40681-016-0001-9
[7] Jeschke J, Collignon E, Fuks F. Portraits of TET-mediated DNA hydroxymethylation in cancer[J]. Curr Opin Genet Dev, 2016, 36: 16-26. doi: 10.1016/j.gde.2016.01.004
[8] Hsu C H, Peng KL, Kang ML, et al. TET1 suppresses cancer invasion by activating the tissue inhibitors of metalloproteinases[J]. Cell Rep, 2012, 2(3): 568-79. doi: 10.1016/j.celrep.2012.08.030
[9] Neri F, Dettori D, Incarnato D, et al. TET1 is a tumour suppressor that inhibits colon cancer growth by derepressing inhibitors of the WNT pathway[J]. Oncogene, 2015, 34(32): 4168-76. doi: 10.1038/onc.2014.356
[10] 谢素红, 翁文浩, 李智. TET1对肾癌786-O细胞增殖的影响及其相关机制[J].肿瘤, 2012, 32(12): 962-8. doi: 10.3781/j.issn.1000-7431.2012.12.003 Xie SH, Weng WH, Li Z. The effect of TET1 on the proliferation of renal cancer 786-O cells and its related mechanism[J]. Zhong Liu, 2012, 32(12): 962-8. doi: 10.3781/j.issn.1000-7431.2012.12.003
[11] Valastyan S, Weinberg RA. Tumor metastasis: molecular insights and evolving paradigms[J]. Cell, 2011, 147(2): 275-92. doi: 10.1016/j.cell.2011.09.024
[12] Nguyen DX, Bos PD, Massagué J. Metastasis: from dissemination to organ-specific colonization[J]. Nat Rev Cancer, 2009, 9(4): 274-84. doi: 10.1038/nrc2622
[13] De Craene B, Berx G. Regulatory networks defining EMT during cancer initiation and progression[J]. Nat Rev Cancer, 2013, 13(2): 97-110. doi: 10.1038/nrc3447
[14] Nieto MA. Epithelial plasticity: a common theme in embryonic and cancer cells[J]. Science, 2013, 342(6159): 1234850. doi: 10.1126/science.1234850
[15] Gheldof A, Berx G. Cadherins and epithelial-to-mesenchymal transition[J]. Prog Mol Biol Transl Sci, 2013, 116(1): 317-36. https://biblio.ugent.be/publication/3164299
[16] Yan D, Avtanski D, Saxena NK, et al. Leptin-induced epithelial-mesenchymal transition in breast cancer cells requires β-catenin activation via Akt/GSK3-and MTA1/Wnt1 protein-dependent pathways[J]. J Biol Chem, 2012, 287(11): 8598-612. doi: 10.1074/jbc.M111.322800
[17] Arend RC, Londoño-Joshi AI, Straughn JM, et al. The Wnt/β-catenin pathway in ovarian cancer: a review[J]. Gynecol Oncol, 2013, 131(3): 772-9. doi: 10.1016/j.ygyno.2013.09.034
[18] Zeisberg M, Neilson EG. Biomarkers for epithelial-mesenchymal transitions[J]. J Clin Invest, 2009, 119(6): 1429-37. doi: 10.1172/JCI36183
[19] Iwai S, Yonekawa A, Harada C, et al. Involvement of the Wnt-β-catenin pathway in invasion and migration of oral squamous carcinoma cells[J]. Int J oncol, 2010, 37(5): 1095-103. https://www.spandidos-publications.com/ijo/37/5/1095
[20] Gavert N, Ben-Ze'ev A. Epithelial-mesenchymal transition and the invasive potential of tumors[J]. Trends Mol Med, 2008, 14(5): 199-209. doi: 10.1016/j.molmed.2008.03.004
[21] Liu F, Zhou Y, Zhou D, et al. Whole DNA methylome profiling in lung cancer cells before and after epithelial-to-mesenchymal transition[J]. Diagn Pathol, 2014, 9: 66. doi: 10.1186/1746-1596-9-66
[22] Tsai YP, Chen HF, Chen SY, et al. TET1 regulates hypoxia-induced epithelial-mesenchymal transition by acting as a co-activator[J]. Genome Biol, 2014, 15(12): 513. doi: 10.1186/s13059-014-0513-0
[23] Yang L, Yu SJ, Hong Q, et al. Reduced expression of TET1, TET2, TET3 and TDG mRNAs are associated with poor prognosis of patients with early breast cancer[J]. PloS One, 2015, 10(7): e0133896. doi: 10.1371/journal.pone.0133896
[24] Sun M, Song CX, Huang H, et al. HMGA2/TET1/HOXA9 signaling pathway regulates breast cancer growth and metastasis[J]. Proc Natl Acad Sci U S A, 2013, 110(24): 9920-5. doi: 10.1073/pnas.1305172110



 下载:
下载: