Effect of CDK7 Inhibitor THZ1 on Proliferation and Apoptosis of Breast Cancer Cells and Related Mechanism
-
摘要:目的
探讨细胞周期蛋白依赖性蛋白激酶7(CDK7)特异性抑制剂THZ1对人乳腺癌细胞系MCF7、SkBr3及Hs578T增殖及凋亡的作用及其分子机制。
方法采用MTT、流式细胞术、Western blot等方法检测细胞活力、细胞周期和凋亡的变化情况。
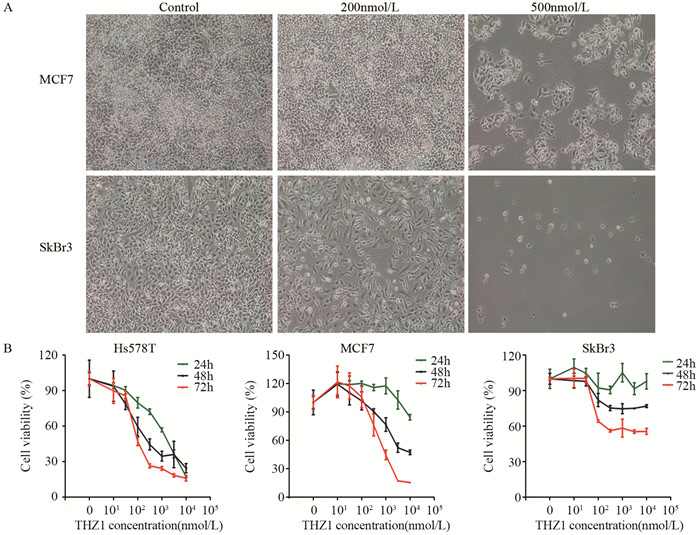
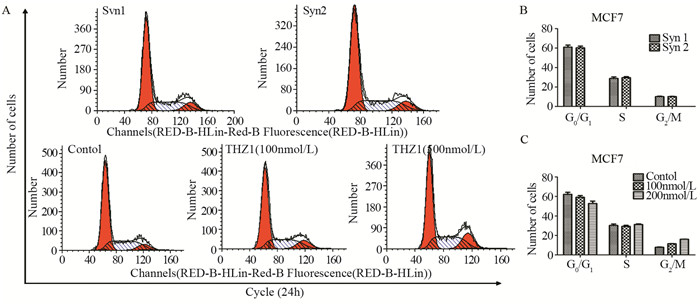
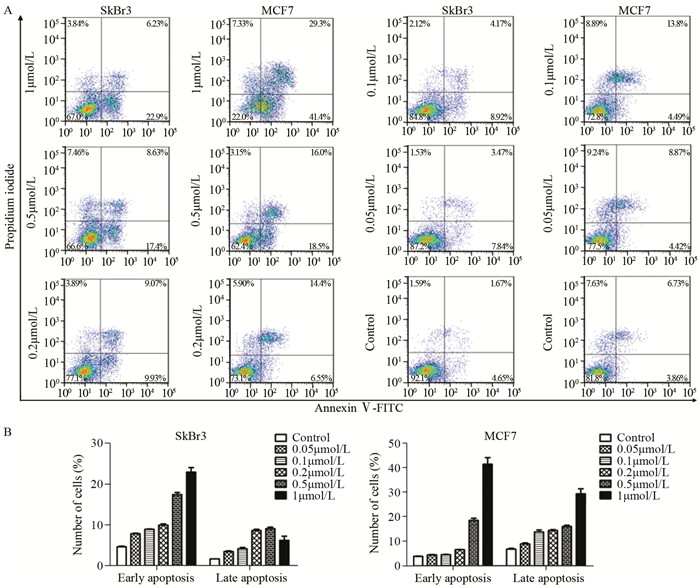
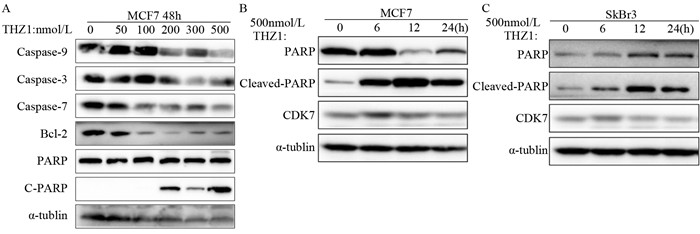
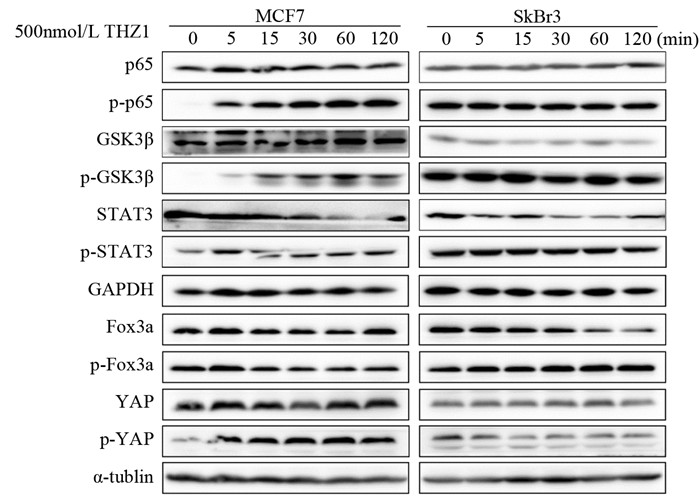
结果500 nmol/L THZ1处理细胞,显微镜观察细胞数明显减少;MTT实验表明THZ1呈剂量及时间依赖性抑制细胞的增殖;细胞饥饿培养24 h以同步化在G1/S期,THZ1继续处理24 h, 流式细胞术检测G2/M期细胞数增多。THZ1引起细胞G2/M期阻滞;THZ1呈剂量及时间依赖性诱导细胞早期凋亡与晚期凋亡;Western blot结果表明,THZ1可导致Cleaved-PARP上调,Bcl-2的显著下调和p65、GSK3蛋白磷酸化水平的明显上调。
结论THZ1能抑制MCF7、SkBr3及Hs578T细胞增殖,诱导其细胞周期阻滞及细胞早、晚期凋亡,可作为乳腺癌治疗潜在的候选药物。
Abstract:ObjectiveTo investigate the effect of THZ1, a selective inhibitor of cyclin-dependent protein kinase 7(CDK7), on the proliferation and apoptosis of human breast cancer cell lines MCF7, SkBr3 and Hs578T.
MethodsMTT, flow cytometry and Western blot were used in the experiment to detect cell viability, cell cycle and apoptosis.
ResultsAfter treated with 500 nmol/L THZ1, the number of cells was obviously decreased based on microscope observation. MTT assay showed that the proliferation of breast cancer cells was inhibited in a dose-and time-dependent manner after THZ1 treatment. Cells were synchronized at the G1/S transition by starved for 24h, and then treated with indicated doses of THZ1 for 24h. FCM results showed that the number of cells in G2/M phase was increased, indicating the G2/M phase cell cycle arrest was induced. Furthermore, THZ1 induced cells apoptosis in a dose-and time-dependent manner. The expression of Cleaved-PARP were significantly up-regulated and anti-apoptotic gene Bcl-2 were down-regulated, and the NF-κB and GSK3β pathway were activated via increasing the phosphorylation of p65 and GSK3β.
ConclusionTHZ1 can inhibit the proliferation of MCF7, SkBr3 and Hs578T cells, induce cell cycle arrest and cell apoptosis in a dose-and time-dependent manner. It suggested that THZ1 can be used as a potential candidate drug for breast cancer.
-
Key words:
- CDK7 /
- Breast cancer /
- Apoptosis /
- PARP
-
0 引言
胃癌是起源于胃黏膜上皮细胞病变的消化道恶性肿瘤,具有较高的发病率与死亡率[1]。基因突变、不良饮食结构、病菌感染及吸烟等因素均可诱发胃癌。与传统开放根治手术相比,腹腔镜胃癌根治术因具有创伤较小、术后恢复较快等特点,已成为临床治疗胃癌的主要外科手段,可有效提高患者生存质量,延长生存期,但仍有部分患者在术后出现复发,严重影响患者预后[2]。因此,积极探讨影响胃癌腹腔镜根治术后复发的相关因素,以指导临床制定合适的防控措施,对减少患者术后复发具有重要意义。近年来,有研究显示[3]有多种基因、细胞因子及化合物参与了肿瘤细胞的发生发展过程,其中肿瘤坏死因子受体相关因子4(tumor necrosis factor receptor associated factor 4, TRAF4)和核糖体S6蛋白激酶4(ribosomal s6 protein kinase 4, RSK4)在肿瘤细胞中存在异常表达。TRAF4属于TRAF家族类蛋白,可介导肿瘤细胞内信号传递,有研究指出[4]TRAF4在乳腺癌、结直肠癌等肿瘤组织中高表达。RSK4为核糖体S6蛋白激酶家族成员之一,参与丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路的转导,具有调控细胞生长、增殖、分化的作用,有研究指出[5]RSK4蛋白在结直肠癌细胞株中低表达,可能参与了结直肠癌的发生发展。以往研究大多是对TRAF4或RSK4蛋白在癌细胞中的作用及其与患者临床病理特征的关系进行分析,但关于TRAF4和RSK4蛋白表达是否与胃癌患者腹腔镜根治术后复发相关不甚明确。鉴于此,本研究探讨了胃癌组织TRAF4和RSK4蛋白的表达与患者腹腔镜根治术后复发的相关性,旨在为临床制定合适的防控措施提供参考依据。
1 资料与方法
1.1 一般资料
选取本院2016年1月~2019年1月收治的176例胃癌患者的临床资料,其中男105例,女71例;年龄39~76岁,平均(53.18±10.09)岁;胃癌病变部位:胃窦80例,贲门55例,幽门28例,其他部位13例;胃癌组织类型:乳头状腺癌69例,管状腺癌55例,黏液腺癌39例,其他组织类型13例;TNM分期:Ⅰ期28例,Ⅱ期85例,Ⅲ期63例;肿瘤分化程度:高分化48例,中分化63例,低分化65例。本研究经医院伦理委员会批准通过。
纳入标准:(1)经临床病理及胃镜检查确诊为胃癌;(2)初治,满足腹腔镜胃癌根治术适应证且均接受腹腔镜胃癌根治术治疗及淋巴结清扫术;(3)患者或家属知晓并签署知情同意书。排除标准:(1)既往接受过放疗、靶向治疗、化疗或胃癌根治术者;(2)严重精神疾病患者;(3)既往胃癌术后出现复发的患者;(4)严重心、肾衰竭或功能不全者;(5)合并患有其他恶性肿瘤者;(6)术前已出现胃癌远处转移者;(7)合并患有免疫系统或血液系统疾病者;(8)术后预计生存期 < 3个月。
1.2 方法
1.2.1 TRAF4和RSK4蛋白表达检测
纳入研究患者均采取腹腔镜胃癌根治术治疗,并于术中留取胃癌组织及癌旁组织(距肿瘤切缘外约3 cm)。将组织经10%甲醛固定,常规石蜡包埋制备成组织蜡块,使用免疫组织化学法测定TRAF4和RSK4蛋白表达。步骤如下:将胃癌及癌旁组织蜡块连续切片(4 μm)3张,常规脱蜡水化,然后进行抗原修复,再使用1%过氧化氢(H2O2)-甲醇消除内源性过氧化物酶,室温下静置10 min后PBS洗3次,5%血清白蛋白(BSA)孵育20 min,分别加入兔抗人TRAF4多克隆抗体及兔抗人RSK4单克隆抗体,4℃孵育过夜。次日37℃复温1 h,后PBS洗3次,分别加入山羊抗兔二抗抗体,室温孵育2 h,PBS洗3次后,二氨基联苯胺(DAB)进行显色,蒸馏水清洗终止显色,苏木精对比染色,充分水洗。脱水后,以中性树胶封固,于显微镜下观察。同时用PBS代替一抗作为阴性对照。
1.2.2 结果判定
在400高倍镜视野下随机选取5个视野,各视野均计数100个细胞,记录阳性细胞占比,其中TRAF4阳性细胞表现为细胞核或细胞质出现棕黄色或棕褐色颗粒,RSK4阳性细胞表现为细胞质出现棕黄色或棕褐色颗粒。
蛋白表达情况判定标准:(1)按照染色强度判定:细胞未着色记为0分,呈淡棕黄色记为1分,呈棕黄色记为2分,呈明显的棕黄色或深褐色记为3分;(2)按照阳性细胞(棕黄色)所占比例判定:阳性细胞占比 < 5%记为0分,5%≤阳性细胞占比 < 25%记为1分,25%≤阳性细胞占比 < 50%记为2分,50%≤阳性细胞占比 < 75%记为3分,阳性细胞占比≥75%记为4分;将染色强度与阳性细胞占比两者得分相乘, < 2分为蛋白表达阴性,≥2分为蛋白表达阳性。
术后复发判定与分组:腹腔镜胃癌根治术后,前3个月每月对患者电话或微信随访一次,上门访问一次,3个月后每隔1个月电话随访1次,随访期间嘱患者定期至医院复诊,共随访36个月。复发判定:经影像学检查(CT、PET-CT、MRI)、组织病理学检查(胃镜活检、穿刺或再次手术)明确,发现手术切除部位或附近新发肿瘤或出现远处组织器官转移等。将术后复发者归为复发组,反之归为未复发组。
1.2.3 影响因素分析
统计可能影响胃癌患者腹腔镜根治术后复发的影响因素,包括患者年龄、性别、最大肿瘤直径、分化程度、TNM分期、Lauren分型、浸润深度、腹水、淋巴结转移、术后辅助化疗、TRAF4蛋白表达、RSK4蛋白表达、规律饮食、家族胃癌病史、幽门螺旋杆菌感染等,将其作为自变量(X),对其进行赋值,结果见表 1;另将腹腔镜根治术后复发情况作为因变量(Y),未复发记为0,复发记为1;分析因变量与自变量间的关系。
表 1 胃癌患者腹腔镜根治术后复发影响因素赋值情况Table 1 Assignment of independent variables influencing recurrence after laparoscopic radical gastrectomy
1.3 观察指标
(1)胃癌组织与癌旁组织TRAF4和RSK4蛋白表达;(2)不同病理特征患者胃癌组织TRAF4和RSK4蛋白表达;(3)术后复发情况及复发组与未复发组胃癌组织TRAF4和RSK4蛋白表达比较;(4)胃癌患者腹腔镜根治术后复发的影响因素:风险比(HR)、95%CI;(5)胃癌组织TRAF4和RSK4蛋白表达对腹腔镜根治术后复发的预测作用。
1.4 统计学方法
使用SPSS23.0软件进行统计学分析,计数资料采用例数和百分数(n(%))表示,采用χ2检验。当理论频数为1~5则采用校正卡方检验,当理论频数 < 1或样本量 < 40则采用Fisher精确检验;等级比较采用秩和检验;采用单因素和多因素Cox回归分析法分析胃癌腹腔镜根治术后复发的影响因素;以术后实际复发情况为金标准,计算各影响因素预测术后复发的敏感度、特异性与准确度,比较采用χ2检验。P < 0.05为差异有统计学意义。
2 结果
2.1 胃癌组织与癌旁组织TRAF4和RSK4蛋白表达比较
胃癌组织中TRAF4蛋白阳性表达率高于癌旁组织(P < 0.05),RSK4蛋白阳性表达率低于癌旁组织(P < 0.05),见表 2、图 1。
表 2 胃癌组织与癌旁组织TRAF4和RSK4蛋白表达比较(n(%))Table 2 Comparison of TRAF4 and RSK4 protein expression between gastric cancer tissues and adjacent tissues (n(%))
2.2 不同病理特征患者胃癌组织TRAF4和RSK4蛋白表达比较
低分化、TNM Ⅲ期、浸润深度T3~T4、淋巴结转移患者胃癌组织TRAF4蛋白阳性表达率均分别高于中/高分化、TNMⅠ/Ⅱ期、浸润深度T1~T2、无淋巴结转移患者(P < 0.05),而RSK4蛋白阳性表达率分别低于中/高分化、TNMⅠ/Ⅱ期、浸润深度T1~T2、无淋巴结转移患者(P < 0.05),见表 3。
表 3 不同病理特征患者胃癌组织TRAF4和RSK4蛋白表达比较(n(%))Table 3 Comparison of TRAF4 and RSK4 protein expression in gastric cancer tissues of patients with different pathological characteristics (n(%))
2.3 复发组与未复发组胃癌组织一般资料比较
对176例行腹腔镜根治术的胃癌患者进行36个月的术后随访,随访率100%,其中有56例患者胃癌复发,120例患者未复发,复发率为31.82%(56/176)。复发组胃癌组织TRAF4蛋白阳性表达率高于未复发组(P < 0.05),RSK4蛋白阳性表达率低于未复发组(P < 0.05),复发组最大肿瘤直径、分化程度、TNM分期、浸润深度、淋巴结转移、术后辅助化疗、规律饮食、家族胃癌病史与未复发组比较,差异有统计学意义(P < 0.05),见表 4。
表 4 复发组与未复发组一般资料比较(n(%))Table 4 Comparison of general data between recurrence group and non-recurrence group (n(%))
2.4 影响腹腔镜胃癌根治术后复发的单因素Cox回归分析
结果显示最大肿瘤直径 > 5 cm、低分化程度、TNM分期Ⅲ期、浸润深度T3~T4、淋巴结转移、术后未辅助化疗、TRAF4蛋白阳性表达、家族胃癌病史均是腹腔镜胃癌根治术后患者复发的危险因素(P < 0.05),而RSK4蛋白阳性表达、规律饮食是保护因素(P < 0.05),见表 5。
表 5 影响腹腔镜胃癌根治术后复发的单因素Cox回归分析Table 5 Cox regression analysis of single factor influencing recurrence after laparoscopic radical gastrectomy
2.5 影响腹腔镜胃癌根治术后复发的多因素分析
以单因素Cox回归分析中P < 0.10的因素为自变量,进行多因素Cox回归分析,结果显示最大肿瘤直径 > 5 cm、低分化程度、TNM分期Ⅲ期、浸润深度T3~T4、淋巴结转移、术后未辅助化疗、TRAF4蛋白阳性表达均是胃癌患者腹腔镜根治术后复发的危险因素(P < 0.05),而RSK4蛋白阳性表达、规律饮食均是保护因素(P < 0.05),见表 6。
表 6 影响腹腔镜胃癌根治术后复发的多因素Cox回归分析Table 6 Cox regression analysis of multiple factors influencing recurrence after laparoscopic radical gastrectomy
2.6 TRAF4和RSK4蛋白表达对胃癌腹腔镜根治术后复发的预测作用
胃癌组织TRAF4和RSK4蛋白表达联合预测胃癌腹腔镜根治术后复发的准确度高于各蛋白单独预测(χ2=34.566、47.239, P < 0.001),且高于最大肿瘤直径 > 5 cm、低分化、TNMⅢ期、浸润深度T3~T4、淋巴结转移、术后未辅助化疗、未规律饮食(χ2=18.810、4.380、15.286、17.902、6.588、10.570、20.682,P=0.000、0.036、0.000、0.000、0.010、0.001、0.000),而与TRAF4、RSK4蛋白表达联合其他七项比较差异无统计学意义(χ2=2.982, P=0.084),见表 7。
表 7 TRAF4和RSK4蛋白表达对胃癌腹腔镜根治术后复发的预测作用Table 7 Predictive effect of TRAF4 and RSK4 protein expression on recurrence of gastric cancer after laparoscopic radical surgery
3 讨论
胃癌是临床常见的消化道恶性肿瘤之一,近年来,我国胃癌发病率逐渐上升且呈年轻化趋势,严重威胁患者的身心健康[6]。腹腔镜根治术是目前临床治疗胃癌较为广泛的微创术式,但术后复发仍是不容忽视的问题[7]。本研究中,胃癌患者腹腔镜根治术后3年的复发率为31.82%,稍低于赵车冬等[8]研究显示的胃癌根治术后复发率(术后随访3年,复发率41.67%),可能与所选样本间的个体差异性、具体手术方式、术后干预措施等差异有关,但均表明胃癌根治术后有较高的复发风险,严重影响患者预后。因此,对影响胃癌腹腔镜根治术后复发的因素进行探索分析很重要。
本研究显示,胃癌组织中TRAF4蛋白阳性表达率较癌旁组织高,RSK4蛋白阳性表达率较癌旁组织低,提示TRAF4、RSK4蛋白在胃癌组织中均异常表达,可能与胃癌的发生发展有关。TRAF家族蛋白主要参与细胞的增殖、分化及凋亡的调控,在多种生命活动中发挥重要的作用,其中TRAF4通过间接作用或形成复合体的方式在细胞质、细胞膜和细胞核中迁移而发挥作用[9]。TRAF4与丝裂原活化蛋白激酶激酶4结合可激活c-Jun氨基酸末端激酶(JNK)途径,而JNK途径与肿瘤发生密切相关[10]。有研究表明[11],结直肠癌组织中TRAF4蛋白阳性表达率显著高于癌旁组织,与本研究结果相似。RSK4作为细胞内重要的调控因子,可以调节细胞周期(G0/S期、G1/S期)细胞比例,对癌细胞的过度增殖具有抑制作用[12]。有研究显示[13]RSK4蛋白在多种肿瘤细胞中如乳腺癌、结直肠癌等低表达,表明RSK4蛋白可能具有类似抑癌基因的作用。因而胃癌组织中RSK4蛋白阳性表达率较癌旁组织低,且RSK4蛋白阳性表达率下降会降低机体对肿瘤发生的调控作用,增加肿瘤发生的风险。另本研究结果显示,低分化、TNMⅢ期、浸润深度T3~T4、淋巴结转移患者胃癌组织TRAF4蛋白阳性表达率较中/高分化、TNMⅠ/Ⅱ期、浸润深度T1~T2、无淋巴结转移患者高,而RSK4蛋白阳性表达率较中/高分化、TNMⅠ/Ⅱ期、浸润深度T1~T2、无淋巴结转移患者低,提示TRAF4和RSK4蛋白表达可能与胃癌患者分化程度、TNM分期、浸润深度以及淋巴结转移情况存在一定的关联。TRAF4可通过调控PI3K/AKT/Oct4、Wnt/β-catenin等多条信号通路促进癌细胞的增殖、侵袭、迁移以及上皮间质转化[14-15]。RSK4表达下降可促使其阻碍细胞蛋白合成的作用减弱,丧失保护肿瘤细胞分化调控作用,抑制肿瘤生长的功能减退,导致肿瘤进展,其过表达可能通过抑制PI3K/AKT信号通路而抑制肿瘤细胞迁移、侵袭与生长[16]。
本研究结果还显示,复发组胃癌组织TRAF4蛋白阳性表达率高于未复发组,RSK4蛋白阳性表达率低于未复发组,且多因素分析表明TRAF4蛋白阳性表达是胃癌患者腹腔镜根治术后复发的危险因素,RSK4蛋白阳性表达是其保护因素,提示胃癌组织TRAF4和RSK4蛋白表达情况与患者根治术后复发密切相关。TRAF4是一种定位于细胞核内的重要信号转导蛋白,已被证实参与了多种肿瘤细胞的发生发展过程。相关研究报道[17]显示,TRAF4表达上调可以诱导G1/S-特异性周期蛋白-D1、调节基因、癌基因、聚ADP核糖聚合酶1等靶分子的表达,还具有激活Wnt/β-catenin信号通路促进癌细胞生长、迁移的作用。因此,TRAF4蛋白高表达可促进肿瘤进一步生长与转移,增加胃癌患者术后复发的风险。RSK4是位于细胞质内的一种核糖体修饰因子,可以通过对核糖体羧基末端进行修饰而降低染色体DNA配对的错配风险,还可以提高错配修复因子半胱氨酸的活性[18]。另RSK4对癌细胞低分化具有重要的抑制作用,可降低癌细胞黏附血管内皮或淋巴管内皮的能力,抑制癌症进展[19]。有研究表明[20],过表达RSK4能够抑制乳腺癌细胞的侵袭与转移。当RSK4蛋白表达降低时,其抑制癌细胞低分化、侵袭与转移等的能力减弱,则肿瘤进展的风险增加,患者术后复发的概率升高。因此,RSK4蛋白阳性表达可以及时监控肿瘤的发生,抑制癌细胞低分化,为胃癌患者腹腔镜根治术后复发的保护因素。本研究结果显示,TRAF4和RSK4蛋白表达联合用于预测胃癌腹腔镜根治术后复发中具有较高的准确度,提示临床可根据此两种蛋白表达情况而对胃癌患者根治术后复发进行评估,尽可能及早地给予针对性干预对策以减少术后复发。
此外,本研究结果显示,最大肿瘤直径 > 5 cm、低分化程度、TNMⅢ期、浸润深度T3~T4、淋巴结转移、术后未辅助化疗亦均是胃癌患者腹腔镜根治术后复发的危险因素,而规律饮食是其保护因素。淋巴管壁较薄且管径较细,常与静脉或血管伴行,当肿瘤直径越大,侵犯周围淋巴结的程度就越深,当淋巴管壁被肿瘤细胞逐步浸润后,进入淋巴管随淋巴液被带至淋巴结,并以此为中心长出同样肿瘤,最终引起肿瘤转移至淋巴结[21]。有研究显示[22],术前出现淋巴结转移的肿瘤患者术后复发率超50%,与本研究结果一致,表明淋巴结转移可能在肿瘤复发中起重要作用,成为术后评估肿瘤复发转移的重要预测指标;与此同时,肿瘤直径越大,浸润程度越深,就会越容易突破浆膜层对周围组织或肝、肾器官产生侵犯,可能会导致肿瘤发生转移,引起局部复发[23]。分化程度越低,TNM分期越高,表示恶性程度越高,出现淋巴结转移的可能性越大,术后复发的风险越高[24]。行根治性手术治疗时,可能存在微小或潜在癌灶没有发现而未能完全被清除,术后实施一定周期的辅助化疗可杀灭癌细胞,控制肿瘤进展,但若未进行化疗干预,残留的病灶则可逐渐发展甚或转移,导致术后复发。有研究表明[25],术后化疗 > 3周期的患者相较于未化疗或化疗≤3周期的患者具有更低的术后复发率。另规律饮食可以保证机体营养的正常供应,提高患者免疫力,降低术后复发的风险。
综上所述,TRAF4蛋白在胃癌组织异常高表达,而RSK4蛋白则异常低表达,二者异常表达均与胃癌患者腹腔镜根治术后复发密切相关,可对术后复发进行较好地预测。最大肿瘤直径 > 5 cm、低分化程度、TNMⅢ期、浸润深度T3~T4、淋巴结转移、术后化疗情况、是否规律饮食等是胃癌腹腔镜根治术后复发的影响因素,临床中可据此加强对胃癌患者的监督与管理,制定针对性干预方案,以促进患者预后改善。本研究通过对胃癌组织中TRAF4和RSK4蛋白表达情况与患者腹腔镜根治术后复发的关系分析,而为临床术后及时制定合理的防控方案提供了指导依据,同时亦为胃癌的治疗研究提供了一个新方向,但本研究纳入复发的样本量较小,且未对深层作用机制进行探讨,后续需扩大样本量进一步探索。
-
-
[1] Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(1): 9-29. doi: 10.3322/caac.21208
[2] Fan L, Strasser-Weippl K, Li JJ, et al. Breast cancer in China[J]. Lancet Oncol, 2014, 15(7): e279-89. doi: 10.1016/S1470-2045(13)70567-9
[3] 韦微, 刘巧, 杜军, 等. G蛋白耦联雌激素受体(GPER)作为三阴性乳腺癌治疗靶标的研究[J].中国药理学通报, 2015, 31(B11): 238-9. http://cdmd.cnki.com.cn/Article/CDMD-10631-1016782240.htm Wei W, Liu Q, Du J, et al. Research in G Protein-coupled Estrogen Receptor(GPER) as Cancer Therapy Target of Triple-negative Breast Cancer[J]. Zhongguo Yao Li Xue Tong Bao, 2015, 31(B11): 238-9. http://cdmd.cnki.com.cn/Article/CDMD-10631-1016782240.htm
[4] Tane S, Ikenishi A, Okayama H, et al. CDK inhibitors, p21(Cip1) and p27(Kip1), participate in cell cycle exit of mammalian cardiomyocytes[J]. Biochem Biophys Res Commun, 2014, 443(3): 1105-9. doi: 10.1016/j.bbrc.2013.12.109
[5] Bose P, Simmons GL, Grant S. Cyclin-dependent kinase inhibitor therapy for hematologic malignancies[J]. Expert Opin Investig Drugs, 2013, 22(6): 723-38. doi: 10.1517/13543784.2013.789859
[6] Santamaría Nuñez G, Robles CM, Giraudon C, et al. Lurbinectedin Specifically Triggers the Degradation of Phosphorylated RNA Polymerase Ⅱ and the Formation of DNA Breaks in Cancer Cells[J]. Mol Cancer Ther, 2016, 15(10): 2399-412. doi: 10.1158/1535-7163.MCT-16-0172
[7] 罗年安, 屈亚琦, 董瑞.乳腺癌的治疗进展[J].现代生物医学进展, 2015, 15(1): 160-2, 166. http://www.cnki.com.cn/Article/CJFDTOTAL-SWCX201501037.htm Luo NA, Qu YQ, Dong R. The Treatment Progress of the Breast Cancer[J]. Xian Dai Sheng Wu Yi Xue Jin Zhan, 2015, 15(1): 160-2, 166. http://www.cnki.com.cn/Article/CJFDTOTAL-SWCX201501037.htm
[8] Nie FQ, Sun M, Yang JS, et al. Long noncoding RNA ANRIL promotes non-small cell lung cancer cell proliferation and inhibits apoptosis by silencing KLF2 and P21 expression[J]. Mol Cancer Ther, 2015, 14(1): 268-77. doi: 10.1158/1535-7163.MCT-14-0492
[9] 谢韶, 丁健, 陈奕. CDK抑制剂在抗肿瘤领域的研发进展[J].药学进展, 2015, 39(10): 734-45. http://www.cnki.com.cn/Article/CJFDTOTAL-YXJZ201510005.htm Xie S, Ding J, Chen Y. Progress in Development of Cyclin-dependent Kinase Inhibitors as Cancer Therapy[J]. Yao Xue Jin Zhan, 2015, 39(10): 734-45. http://www.cnki.com.cn/Article/CJFDTOTAL-YXJZ201510005.htm
[10] Teixeira LK, Wang X, Li Y, et al. Cyclin E deregulation promotes loss of specific genomic regions[J]. Curr Biol, 2015, 25(10): 1327-33. doi: 10.1016/j.cub.2015.03.022
[11] Lo M C, Ngo R, Dai K, et al. Development of a time-resolved fluorescence resonance energy transfer assay for cyclin-dependent kinase 4 and identification of its ATP-noncompetitive inhibitors[J]. Analytical biochemistry, 2012, 421(2): 368-77. doi: 10.1016/j.ab.2011.10.014
[12] Premnath PN, Liu S, Perkins T, et al. Fragment based discovery of arginine isosteres through REPLACE: Towards non-ATP competitive CDK inhibitors[J]. Bioorganic & medicinal chemistry, 2014, 22(1): 616-22. https://www.researchgate.net/publication/259002113_Fragment_based_discovery_of_arginine_isosteres_through_REPLACE_Towards_non-ATP_competitive_CDK_inhibitors
[13] Van Duyne R, Guendel I, Jaworski E, et al. Effect of mimetic CDK9 inhibitors on HIV-1-activated transcription[J]. Journal of molecular biology, 2013, 425(4): 812-29. doi: 10.1016/j.jmb.2012.12.005
[14] Zhang D, Mita M, Shapiro G I, et al. Effect of aprepitant on the pharmacokinetics of the cyclin-dependent kinase inhibitor dinaciclib in patients with advanced malignancies[J]. Cancer chemotherapy and pharmacology, 2012, 70(6): 891-8. doi: 10.1007/s00280-012-1967-y
[15] Hofmeister C C, Poi M, Bowers M A, et al. A phase Ⅰ trial of flavopiridol in relapsed multiple myeloma[J]. Cancer chemotherapy and pharmacology, 2014, 73(2): 249-57. doi: 10.1007/s00280-013-2347-y
[16] Luke J J, D'Adamo D R, Dickson M A, et al. The cyclin-dependent kinase inhibitor flavopiridol potentiates doxorubicin efficacy in advanced sarcomas: preclinical investigations and results of a phase Ⅰ dose-escalation clinical trial[J]. Clinical Cancer Research, 2012, 18(9): 2638-47. doi: 10.1158/1078-0432.CCR-11-3203
[17] Dawson MA, Prinjha RK, Dittmann A, et al. Inhibition of BET recruitment to chromatin as an effective treatment for MLL-fusion leukaemia[J]. Nature, 2011, 478(7370): 529-33. doi: 10.1038/nature10509
[18] Delmore J E, Issa G C, Lemieux M E, et al. BET bromodomain inhibition as a therapeutic strategy to target c-Myc[J]. Cell, 2011, 146(6): 904-17. doi: 10.1016/j.cell.2011.08.017
[19] Kwiatkowski N, Zhang T, Rahl PB, et al. Targeting transcription regulation in cancer with a covalent CDK7 inhibitor[J]. Nature, 2014, 511(7511): 616-20. doi: 10.1038/nature13393
[20] Wang Y, Zhang T, Kwiatkowski N, et al. CDK7-dependent transcriptional addiction in ple-negative breast cancer[J]. Cell, 2015, 163(1): 174-86. doi: 10.1016/j.cell.2015.08.063
[21] Zhou F, Yang Y, Xing D. Bcl-2 and Bcl-xL play important roles in the crosstalk between autophagy and apoptosis[J]. FEBS J, 2011, 278(3): 403-13. doi: 10.1111/j.1742-4658.2010.07965.x
[22] Chen ZX, Pervaiz S. Involvement of cytochrome c oxidase subunits Va and Vb in the regulation of cancer cell metabolism by Bcl-2[J]. Cell Death & Differentiation, 2010, 17(3): 408-20. https://www.researchgate.net/publication/38015738_Involvement_of_cytochrome_c_oxidase_subunits_Va_and_Vb_in_the_regulation_of_cancer_cell_metabolism_by_Bcl-2
[23] Ouyang YB, Lu Y, Yue S, et al. miR-181 targets multiple Bcl-2 family members and influences apoptosis and mitochondrial function in astrocytes[J]. Mitochondrion, 2012, 12(2): 213-9. doi: 10.1016/j.mito.2011.09.001
[24] Dong J, Zhao YP, Zhou L, et al. Bcl-2 upregulation induced by miR-21 via a direct interaction is associated with apoptosis and chemoresistance in MIA PaCa-2 pancreatic cancer cells[J]. Arch med res, 2011, 42(1): 8-14. doi: 10.1016/j.arcmed.2011.01.006
[25] Liu K, Feng T, Liu J, et al. Silencing of the DEK gene induces apoptosis and senescence in CaSki cervical carcinoma cells via the up-regulation of NF-κB p65[J]. Biosci Rep, 2012, 32(3): 323-32. doi: 10.1042/BSR20100141
[26] Si J, Mueller L, Collins SJ. GSK3 inhibitors enhance retinoic acid receptor activity and induce the differentiation of retinoic acid-sensitive myeloid leukemia cells[J]. Leukemia, 2011, 25(12): 1914-8. doi: 10.1038/leu.2011.171
[27] Cayrol F, Praditsuktavorn P, Fernando TM, et al. THZ1 targeting CDK7 suppresses STAT transcriptional activity and sensitizes T-cell lymphomas to BCL2 inhibitors[J]. Nat Commun, 2017, 8: 14290. doi: 10.1038/ncomms14290
[28] Zhang J, Yang X, Wang Y, et al. Low expression of cyclinH and cyclin-dependent kinase 7 can decrease the proliferation of human esophageal squamous cell carcinoma[J]. Dig Dis Sci, 2013, 58(7): 2028-37. doi: 10.1007/s10620-013-2597-x
[29] Tu K, Yang W, Li C, et al. Fbxw7 is an independent prognostic marker and induces apoptosis and growth arrest by regulating YAP abundance in hepatocellular carcinoma[J]. Mol Cancer, 2014, 13: 110. doi: 10.1186/1476-4598-13-110



 下载:
下载: