Operative Outcomes of Video-Assisted Thoracoscopic Lobectomy for Non-small Cell Lung Cancer
-
摘要:目的
探讨胸腔镜肺叶切除术治疗非小细胞肺癌的安全性、可靠性及疗效。
方法回顾性分析海军总医院116例采用电视胸腔镜行肺叶切除术的Ⅰ~Ⅲa期非小细胞肺癌临床资料,其中男62例、女54例;中位年龄:(59.5±11.9)岁(范围:35~82岁)。采用Kaplan-Meier法对随访结果进行生存率统计。
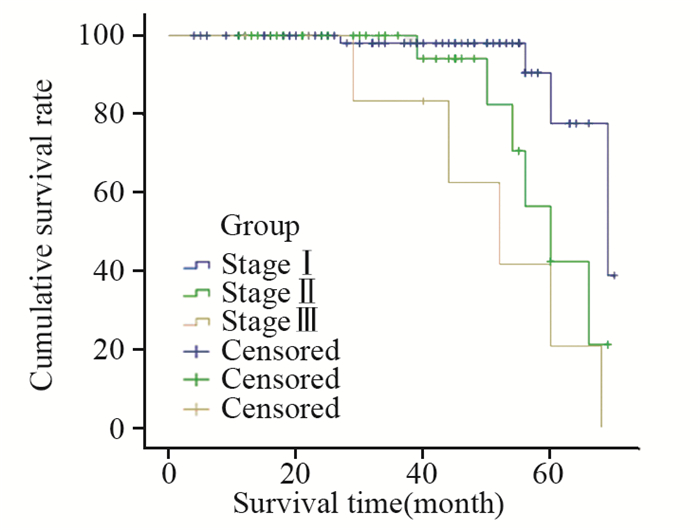
结果无围术期死亡。手术时间64~276 min,出血量60~560 ml,术后住院时间5~12天。11例患者围术期发生并发症,均经对症处理恢复,平均清扫淋巴结12~31枚。随访期间共死亡11例,4例失访。116例患者5年总生存率:Ⅰ期77.6%、Ⅱ期42.4%、Ⅲa期20.8%。
结论胸腔镜肺叶切除术创伤小、疼痛轻,术后恢复快、住院时间短。生存率与开胸手术相当,已成为早中期肺癌治疗的标准术式。
-
关键词:
- 电视胸腔镜肺叶切除术 /
- 非小细胞肺癌 /
- 系统淋巴结清扫 /
- 生存率
Abstract:ObjectiveTo evaluate the safety, efficacy and clinical outcomes of complete video-assisted thoracoscopic lobectomy on non-small cell lung cancer(NSCLC).
MethodsWe retrospectively analyzed the clinical data of 116 NSCLC patients (62 male, 54 female, median age: (59.5±11.9) years old, range: 35-82 years old) who underwent complete video-assisted thoracoscopic lobectomy in the Navy General Hospital of PLA. The survival rates from the follow-up data was analyzed and calculated by Kaplan-Meier method.
ResultsNo perioperative mortality was observed. Operation time was 64-276 min and intraoperative blood loss was 60-560 ml. Postoperative hospital stay was 5-12days. Eleven patients had postoperative complications and were all cured by conservative treatment. Mean number of dissected lymph nodes was 12-31. A total of 11 patients were dead and four patients were lost during the follow-up. Overall 5-year survival rates were 77.6% for stageⅠ, 42.4% for stage Ⅱ and 20.8% for stage Ⅲ, respectively.
ConclusionThe advantages of video-assisted thoracoscopic lobectomy include smaller surgical incision, less injury and postoperative pain, quicker postoperative recovery and shorter hospital stay. Long-term survival rate is comparable to open thoracotomy. Video-assisted thoracoscopic lobectomy can anatomically achieve complete tumor resection and systemati c lymph node dissection, and it has become a standard surgical procedure for early and middle stage NSCLC patients.
-
0 引言
目前经胸腔镜肺叶切除、淋巴结清扫已成为早中期肺癌的标准手术方式,其手术的安全性及有效性也越来越被认可。中国人民解放军海军总医院自2009年8月至2015年8月对116例非小细胞肺癌患者采用电视胸腔镜肺叶切除(video-assisted thoracoscopic lobectomy)及系统淋巴结清扫术(systematic lymph node dissection, SLND),获得了满意的疗效。现对本组手术资料及随访数据进行总结分析,探讨胸腔镜下肺叶切除术的安全性、可靠性以及患者的并发症和生存率。
1 资料与方法
1.1 病例资料
本组共116例,男62例、女54例;中位年龄:(59.5±11.9)(范围35~82)岁,其中35~69岁81例(69.8%)、70~82岁高龄患者35例(30.2%)。患者病变位于左上肺33例、左下肺21例、右上肺30例、右中肺叶8例、右下肺24例。术前经穿刺确诊59例(鳞癌21例、腺癌38例),PET-CT诊断22例并术中冰冻确诊(鳞癌7例、腺癌15例),其余35例为术中冰冻确诊(鳞癌10例、腺癌22例、3例术后确诊腺鳞癌2例及大细胞癌1例)。本组患者不包括同期中转开胸患者。
1.2 手术方式
双腔气管内插管静脉复合全身麻醉,健侧单肺通气,健侧90°卧位。手术采用单操作孔45例:第7或8肋间腋后线作为观察孔长约1 cm;操作孔在腋前线与锁骨中线间第4或第5肋间,长约3~5 cm;两操作孔71例,在肩胛下角线,第8或9肋间加一长约辅助操作孔1 cm。电视胸腔镜采用史塞克30°镜,使用电凝钩、超声刀进行分离、解剖肺门结构,内镜直线切割缝合器处理血管、支气管和叶间裂,完成解剖性肺叶切除,使用电凝钩、超声刀行系统淋巴结清扫术。完成左上肺切除33例(其中1例为左上肺叶切除并左下肺叶局部切除)、左下肺切除21例、右上肺切除30例、右中肺叶切除8例、右下肺切除24例。
1.3 术后随访
入组患者术后建立完整资料档案。对术后分期Ⅰb期以上患者给予第3代铂类药物为基础的化疗方案,治疗4周期。术后一年每3月复查一次,以后每6月复查一次,随访方式采取来院复查、电话或信件进行。
1.4 统计学方法
所有资料采用SPSS17.0软件进行统计学处理,数据采用百分率、均数±标准差(x±s)表示。采用Kaplan-Meier生存曲线对生存率进行分析。P < 0.05为差异有统计学意义。
2 结果
本组无围术期死亡。手术时间64~276 min。出血量60~560 ml,2例肺血管分支出血,经纱布压迫、镜下缝合止血。11例患者围术期发生并发症,其中肺漏气2例、肺部感染1例、肺膨胀不全和肺不张4例、心律失常1例、皮下气肿3例,均经对症治疗后治愈。术后住院时间5~12天。清扫各组淋巴结12~31枚,淋巴结站数(5.6±1.2),主要为第4、5、6、7、10、11组淋巴结。术后病理诊断,见表 1。
表 1 术后病理诊断及分期Table 1 Postoperative pathological diagnosis and stage
随访截至2015年8月,平均随访时间4~69月,随访期间共死亡11例,4例失访(失访计入死亡)。Kaplan-Meier生存统计分析,Ⅰ、Ⅱ、Ⅲ期非小细胞肺癌患者术后5年生存率分别为77.6%、42.4%、20.8%,见图 1。
3 讨论
鉴于传统开胸术式给患者造成极大的痛苦[1],电视胸腔镜肺叶切除术肺癌根治术自20世纪90年代以来发展迅速,随着经验积累和技术进步已在全世界范围内得到广泛应用,其诸多优势已经充分得到肯定,是安全、可靠的手术方式之一。我们对116例非小细胞肺癌患者采用电视胸腔镜肺叶切除术及系统淋巴结清扫术(SLND)治疗,效果良好,平均住院时间缩短、术中出血量少、炎性反应轻、术后并发症少、术后疼痛发生率低。当然,开展初期,手术时间相对较长,随着手术例数的增多及对该技术的熟练掌握,目前平均手术时间(123.1±51.0)min(64~276 min),而且手术方式也从三孔逐步过渡到两孔(单操作孔)。目前,国内外许多学者已进行单孔肺叶切除及淋巴结清扫,Feng等[2]报道一组54例单孔胸腔镜肺叶切除,认为单孔胸腔镜肺叶切除肺癌根治、淋巴结清扫是一种安全有效的手术技术,而手术器械的进步和外科技术的改良有助于该技术的提高。
胸腔镜手术并发症发生率较低。本组患者术后常见并发症有肺漏气、出血、肺部感染、肺不张、心律失常和皮下气肿等,共11例,占9.48%,经对症处理全部治愈。Wang[3]报道一组胸腔镜手术结果,总的术后30日内并发症发生率,胸腔镜组较开放组显著降低,而术后30日并发症发生率较开放组有下降趋势但无显著性差异,胸腔镜组住院时间明显缩短,Kaplan-Meier生存分析显示5年的无疾病生存和总生存率相似。
胸腔镜肺叶切除术的患者机体功能恢复快[4]、术后辅助化疗耐受性好[5]。日本一项比较胸腔镜与开胸手术预后及化疗耐受性的研究结果提示,胸腔镜术后并发症较低并且更有益于患者接受全程足量的化疗(腔镜组和开胸组的化疗率:(84.2% vs. 65.8%, P=0.032))[6],本组对术后分期Ⅰb期以上的患者给予第3代铂类药物为基础的化疗方案,治疗4周期,耐受性好。
胸腔镜肺叶切除手术对高龄、肺功能低的患者[7-8]具有显著优势。Oparka等[9]研究发现对限制性肺通气障碍患者,FEV1预计值 < 60%,胸腔镜肺部并发症明显低于开放手术(P=0.023),肺炎发生率减少(4.3% vs. 21.7%, P < 0.05),重症监护时间缩短(2天vs. 4天, P=0.05),住院时间缩短(7天vs. 10天, P=0.058);而比较FEV1 < 40%患者术后复发和生存结果显示,胸腔镜解剖性肺段切除较开胸肺段切除的住院时间缩短(8天vs. 12天, P=0.054),而5年生存率明显延长(42% vs. 18%, P=0.02)。本组年龄最大的1例患者82岁,右下肺内基底段肿物3.5 cm×3.0 cm,部分肺不张,经皮CT引导下穿刺证实鳞状细胞癌,术前FEV1仅52%(2.1升),考虑到术前局限肺不张,通气血流比有失调,术后肺功能则有可能改善,而肿物较大不能行肺段切除,故行单孔右下肺叶切除,淋巴结清扫,术后经呼吸道管理、呼吸功能锻炼等围手术期处理,恢复顺利,无明显并发症发生,氧饱和度可达95%,术后病理T2N0M0(Ⅰb期),术后未进行任何辅助治疗,目前已随访28月,未见肿瘤复发,生活质量较高。我们认为胸腔镜肺叶切除操作能够减少对健肺的揉捏,刺激少、炎性反应轻;而胸腔镜微小的创伤可减轻术后疼痛,有利于咳嗽、余肺膨胀,使肺功能快速恢复。
关于淋巴结清扫,胸腔镜手术由于镜头能够达到胸腔内的各个部位,视野更清楚,因此对淋巴结的清扫具有独到的优势。本组清扫各组淋巴结12~31枚,淋巴结站数(5.6±1.2),符合肺癌根治标准。Zhang等[10]在一项电视辅助胸腔镜手术(video-assisted thoracoscopic surgery, VATS)和开放手术比较研究中对淋巴结清扫和淋巴结采样,全身和局部复发率和长期生存率的Meta分析提示,两组中总的淋巴结清扫或淋巴结采样与纵隔淋巴结清扫或采样数无显著性差异,但胸腔镜组的全身性或局部复发率明显降低。该研究提示在早期非小细胞肺癌中,胸腔镜在降低复发率和提高生存率上是一种可替代传统开胸手术的正确合适的选择。
淋巴结清扫是影响术后疗效的主要因素,Merritt等[11]研究发现,开放组的淋巴结清扫平均数明显高于腔镜组,开放组中24.6%的患者淋巴结从术前的N0期升至术后的N1或N2期,而腔镜组仅占10%(P=0.05),两组Kaplan-Meier 3年生存率相似。虽然淋巴结升期并未能转化为3年生存率的提高,但笔者认为在胸腔镜手术中应该更加充分地清扫淋巴结。Licht等[12]的一项Ⅰ期NSCLC研究结果也发现腔镜组的淋巴结升期率要低于开放组,而同样多因素生存分析提示两组生存率无显著性差异。另外,淋巴结处理也是胸腔镜中转开胸主要影响因素[13],胸腔镜手术过程中处理困难淋巴结可增加手术时间、增加失血量、术后恢复时间延长,因此,选择正确及时的中转开胸可以减少以上危害。
远期生存质量是评价一种手术方式是否合理的最重要标准。Murakawa等[14]认为,胸腔镜手术在手术时间、出血量、置管时间和住院时间上要优于开放手术,但生存期预后方面与开放手术基本相差不大。Cao等[15]报道一组标准的胸腔镜肺叶切除与传统开胸手术有相似的远期生存效果。Yamamoto等[16]报道325例电视胸腔镜肺叶切除术治疗原发性肺癌,随访时间超过5年,平均随访66月,全组患者5年总体生存率和无病生存率在各分期分别为:Ⅰa期85%和83%、Ⅰb期69%和64%、Ⅱ期48%和37%、Ⅲ期29%和19%。这些数据不次于国际公认的开胸手术生存率。本组116例非小细胞肺癌胸腔镜肺叶切除及系统淋巴结清扫术患者中,有112例完成了随访,平均随访时间4~69月,Ⅰ、Ⅱ、Ⅲ期非小细胞肺癌患者术后5年生存率分别为77.6%、42.4%、20.8%,与上述报道结果相类似。
本组116例胸腔镜肺叶切除手术经验进一步证实了该手术是一种安全、可靠的手术方式,可完成解剖意义上的肿瘤彻底切除和淋巴结清扫,已经成为肺部肿瘤外科治疗的标准手术术式之一。相信随着手术器械的改进和技术的提高,手术适应证范围将继续扩大,并发症发生率会进一步降低,肺癌患者术后的生存率将进一步提高。
-
表 1 术后病理诊断及分期
Table 1 Postoperative pathological diagnosis and stage

-
[1] 杜泽森, 傅俊惠, 郑春鹏, 等.胸腹腔镜联合食管癌切除术与传统开胸术式的临床对比研究[J].肿瘤防治研究, 2014, 41(4): 431-3. http://www.zlfzyj.com/CN/Y2014/V41/I04/431 Du ZS, Fu JH, Zheng CP, et al. Clinical comparison between thoraco-laparoscopic esophagectomy and traditional thoracotomy[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41(4): 431-3. http://www.zlfzyj.com/CN/Y2014/V41/I04/431
[2] Feng M, Shen Y, Wang H, et al. Uniportal video assisted thoracoscopic lobectomy: primary experience from an Eastern center[J]. J Thorac Dis, 2014, 6(12): 1751-6. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3771611/
[3] Wang Y. Video-assisted thoracoscopic surgery for non-small-cell lung cancer is beneficial to elderly patients[J]. Int J Clin Exp Med, 2015, 8(8): 13604-9. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4612986/
[4] Villamizar NR, Darrabie MD, Burfeind WR, et al. Thoracoscopic lobectomy is associated with lower morbidity compared with thoracotomy[J]. J Thorac Cardiovasc Surg, 2009, 138(2): 419-25. doi: 10.1016/j.jtcvs.2009.04.026
[5] Nicastri DG, Wisnivesky JP, Litle VR, et al. Thoracoscopic lobectomy: report on safety, discharge independence, pain, and chemotherapy tolerance[J]. J Thorac Cardiovasc Surg, 2008, 135(3): 642-7. doi: 10.1016/j.jtcvs.2007.09.014
[6] Tane S, Nishio W, Okuma H, et al. Operative outcomes of thoracoscopic lobectomy for non-small-cell lung cancer[J]. Asian Cardiovasc Thorac Ann, 2015, 23(8): 950-57. doi: 10.1177/0218492315596657
[7] Mun M, Kohno T. Video-assisted thoracic surgery for clinical stage Ⅰlung cancer in octogenarians[J]. Ann Thorac Surg, 2008, 85(2): 406-11. doi: 10.1016/j.athoracsur.2007.10.057
[8] Ceppa DP, Kosinski AS, Berry MF, et al. Thoracoscopic lobectomy has increasing benefit in patients with poor pulmonary function: a Society of Thoracic Surgeons Database analysis[J]. Ann Surg, 2012, 256(3): 487-93. doi: 10.1097/SLA.0b013e318265819c
[9] Oparka J, Yan TD, Ryan E, et al. Does video-assisted thoracic surgery provide a safe alternative to conventional techniques in patients with limited pulmonary function who are otherwise suitable for lung resection?[J]. Interact Cardiovasc Thorac Surg, 2013, 17(1): 159-62. doi: 10.1093/icvts/ivt097
[10] Zhang Z, Zhang Y, Feng H, et al. Is video-assisted thoracic surgery lobectomy better than thoracotomy for early-stage non-small-cell lung cancer? A systematic review and Meta-analysis[J]. Eur J Cardiothorac Surg, 2013, 44(3): 407-14. doi: 10.1093/ejcts/ezt015
[11] Merritt RE, Hoang CD, Shrager JB. Lymph node evaluation achieved by open lobectomy compared with thoracoscopic lobectomy for N0 lung cancer[J]. Ann Thorac Surg, 2013, 96(4): 1171-7. doi: 10.1016/j.athoracsur.2013.05.044
[12] Licht PB, Jørgensen OD, Ladegaard L, et al. A national study of nodal upstaging after thoracoscopic versus open lobectomy for clinical stageⅠlung cancer[J]. Ann Thorac Surg, 2013, 96(3): 943-9. doi: 10.1016/j.athoracsur.2013.04.011
[13] Li Y, Wang J. Analysis of lymph node impact on conversion of complete thoracoscopic lobectomy to open thoracotomy[J]. Thorac Cancer, 2015, 6(6): 704-8. doi: 10.1111/tca.2015.6.issue-6
[14] Murakawa T, Ichinose J, Hino H, et al. Long-term outcomes of open and video-assisted thoracoscopic lung lobectomy for the treatment of early stage non-small cell lung cancer are similar: a propensity-matched study[J]. World J Surg, 2015, 39(5): 1084-91. doi: 10.1007/s00268-014-2918-z
[15] Cao C, Zhu ZH, Yan TD, et al. Video-assisted thoracic surgery versus open thoracotomy for non-small-cell lung cancer: a propensity score analysis based on a multi-institutional registry[J]. Eur J Cardiothorac Surg, 2013, 44(5): 849-54. doi: 10.1093/ejcts/ezt406
[16] Yamamoto K, Ohsumi A, Kojima F, et al. Long-term survival after video-assisted thoracic surgery lobectomy for primary lung cancer[J]. Ann Thorac Surg, 2010, 89(2): 353-9. doi: 10.1016/j.athoracsur.2009.10.034



 下载:
下载: