miR-494 Inhibits Proliferation and Invasion of Osteosarcoma Cells MG-63 Through Downregulating Sox9 Expression
-
摘要:目的
探讨miR-494对人骨肉瘤细胞MG-63增殖与侵袭的影响,并验证Sox9是否为miR-494的靶基因。
方法过表达miR-494后,利用CCK-8、克隆形成实验检测MG-63细胞的增殖,利用Transwell实验检测细胞的侵袭能力。Western blot与荧光定量PCR检测Sox9蛋白与mRNA水平的表达。
结果MG-63细胞转染腺病毒miR-494后,miR-494表达明显升高(t=36.78, P=0.000),Ad-miR-494转染组MG-63细胞增殖(F=1.711, P=0.012)、克隆形成(F=2.742, P=0.019)和侵袭能力(F=1.653, P=0.006)较Ad-GFP组下降。过表达miR-494后,Sox9蛋白(F=5.827, P=0.021)和mRNA表达水平(F=5.827, P=0.021)下降。而Sox9的下调使MG-63细胞增殖(t=27.54, P=0.042)、克隆形成(t=29.64, P= 0.026)和侵袭能力(t=32.48, P=0.016)下降。
结论miR-494通过Sox9抑制骨肉瘤细胞MG-63的增殖与侵袭。
Abstract:ObjectiveTo investigate the impact of miR-494 on the proliferation and invasion of human osteosarcoma cells MG-63 and to confirm whether Sox9 is the target gene of miR-494.
MethodsMG-63 cells were transfected with recombinant adenovirus miR-494(Ad-miR-494), CCK-8 and clone formation experiments were employed to determine the proliferation ability of transfected MG-63 cells. Cells invasion abilities were determined by Transwell assay. Real-time PCR was used to analyze the expression of Sox9 mRNA and protein level to confirmthe adenovirus miR-494 expression in MG-63 cells. The protein expression of Sox9 was analyzed by Western blot.
ResultsThe expression of miR-494 was increased obviously (t=36.78, P=0.000) in MG-63 cells which were transfected with Ad-miR-494. CCK-8, clone formation and Transwell experiment results revealed that the proliferation (F=1.711, P=0.012), clone formation (F=2.742, P=0.019) and invasion (F=1.653, P=0.006) abilities of MG-63 cells were markedly inhibited by the overexpression of miR-494. In addition, we observed the decreased Sox9 protein (F=5.827, P=0.021) and mRNA expression (F=5.827, P=0.021) in MG-63 cells which were transfected with Ad-miR-494. And the proliferation (t=27.54, P=0.042), lone formation (t=29.64, P=0.026) and invasion (t=32.48, P=0.016) abilities of MG-63 cells were markedly inhibited by the decreases of Sox9 expression.
ConclusionMG-63 cells proliferation and invasion abilities are suppressed by miR-494, and this process is potentially achieved via suppressing Sox9 expression.
-
Key words:
- miR-494 /
- Osteosarcoma /
- Proliferation /
- Invasion
-
0 引言
骨肉瘤(osteosarcoma,OS)是一种起源于间叶组织最常见的恶性原发性骨肿瘤疾病[1],好发于青少年、恶性程度高、早期定向肺转移率高而预后差。随着治疗方法的改进,患者生存期有所提高。近年来,虽然针对骨肉瘤的发生发展及转移等领域有着大量的研究,但是对其分子机制研究尚不全面。而随着分子遗传相关技术的发展,为进一步研究其发病机制提供了新的思路。
microRNA做为一种短链非编码RNA,在众多的肿瘤发病机制中扮演着重要的角色,通过表观遗传的调控参与肿瘤细胞增殖、分化、侵袭及凋亡[2-3]。miR-494已经被证明在不同癌症类型中,作用不同的靶点干预肿瘤的发生发展及预后,与肿瘤细胞的增殖、分化、 凋亡等密切相关。在胆管细胞型肝癌中,过表达miR-494后,细胞的增殖能力和功能减弱[4];在肺癌中,miR-494过表达后,肺癌细胞株生长受到抑制[5];在结直肠癌中发现miR-494显著下调[6];在神经胶质瘤细胞系U251中,miR-494通过MMP-2增强了U251的侵袭[7]。本研究探讨过表达miR-494对人骨肉瘤细胞株MG-63增殖和侵袭的影响,并对其机制做初步探索,为临床提供一些依据。
1 材料与方法
1.1 细胞培养
人骨肉瘤细胞MG-63和人胚肾细胞HEK-293购自美国模式培养物集存库(ATCC),细胞在含10%胎牛血清、100 μg/ml链霉素、100 U/ml的DMEM高糖培养液中,于37℃、5%CO2的饱和湿度培养箱中培养。
1.2 主要试剂
DMEM高糖培养液和胎牛血清购自美国Hyclone公司,PCR反转录试剂、定量PCR试剂购自日本TaKaRa公司,Cell Counting Kit(CCK-8)购自江苏碧云天生物技术研究所。
1.3 实时荧光定量PCR实验
各组细胞使用TRIzol提取RNA,然后反转录成cDNA。反应体系如下:cDNA 2 μl,SYBR® Premix Ex Taq Ⅱ10 μl,上下游引物各0.4 μl,ddH2O 6.4 μl,加水至20 μl。反应条件:95℃ 5 min,变性95℃ 5 s,退火57℃ 40 s,延伸72℃ 30 s,共40个循环,然后80°C 10 s,实验结果采用2-ΔΔCT法进行表达量相对定量分析。
1.4 Western blot法检测
收集细胞样品,将细胞裂解液裂解后的蛋白样品经8%SDS-PAGE电泳分离后转移至硝酸纤维素膜,与浓度1:1 000的一抗(Sox9兔单克隆抗体,美国Santa Cruz公司)和1:5 000的二抗(美国Santa Cruz公司)孵育后,使用ECL显影成像。
1.5 细胞生长曲线测定
分别取miR-494腺病毒转染骨肉瘤细胞MG-63、绿色荧光蛋白(green fluorescent protein,GFP)空载腺病毒转染骨肉瘤细胞MG-63及野生骨肉瘤细胞MG-63铺于48孔板,细胞初始密度为每孔3 000个,分别于第1、2、3、4、5 d按照CCK-8试剂盒提供的步骤检测细胞活力并进行统计学分析。
1.6 克隆形成实验
收集对数生长期的骨肉瘤细胞,计数后铺于6孔板,细胞密度为每孔100个。将其置于细胞培养箱中正常培养14天后,细胞培养板中出现肉眼可见克隆时,终止培养,用PBS小心冲洗2次,用4%的甲醇固定细胞15 min用瑞氏-吉姆萨染液染色30 min,流水缓慢洗涤后自然空气干燥。在显微镜下计数大于50个细胞的克隆数, 按照如下公式计算克隆形成率[8]:克隆形成率=克隆数/接种细胞数×100%。
1.7 Transwell实验
取对数生长期MG-63细胞制成悬液,将400 μl的7.5×104个每毫升细胞悬液加入到铺有基质胶或没有铺基质胶的上室,24孔板下室加入含20%胎牛血清的培养液600 μl。24 h后染色显微镜下计数并照相。
1.8 核苷酸转染
干扰Sox9合成的寡核苷酸序列由脂质体2000按照说明书转染到MG-63细胞中,Sox9 siRNA序列如下:sense 5’-GCAGCGACGUCAUCUCCAAdTdT-3’,antisense 5’-dTdTCGUCGCUGCAGUAGAGGUU-3’。
1.9 统计学方法
采用SPSS17.0软件进行统计学分析,实验所得数据以均数±标准差(x±s)表示,采用两组独立实验的t检验方法比较两组间差异性。对于同一研究对象的某一观察指标在不同时间点进行的多次测量结果(CCK-8检测细胞活力)采用重复测量的方差分析进行统计学比较,检验水准α=0.05。P<0.05为差异有统计学意义。
2 结果
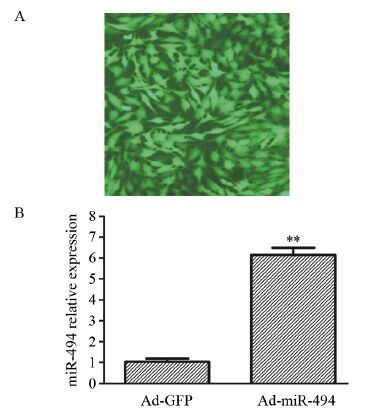
2.1 腺病毒miR-494(Ad-miR-494)转染骨肉瘤细胞MG-63
加入Ad-miR-494和Ad-GFP到MG-63细胞36 h后,观察荧光,Ad-miR-494转染达到70%以上,见图 1A。提取RNA反转录成cDNA后,做RT-PCR检测。Ad-miR-494组MG-63细胞miR-494的相对表达量(6.16±0.34)明显高于Ad-GFP组(1.04±0.15),差异具有统计学意义(t=36.78,P=0.000),见图 1B。
2.2 过表达miR-494对MG-63细胞体外增殖的影响
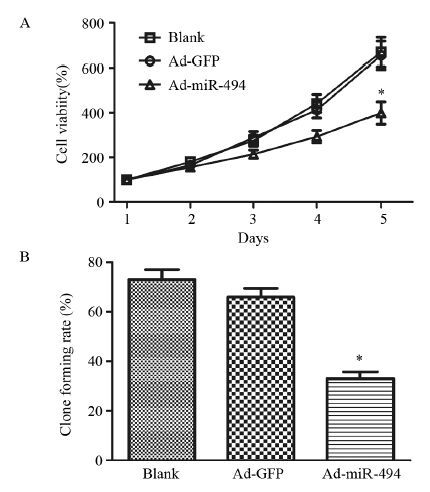
实验分为3组,空白组、Ad-GFP转染组(Ad-GFP)、Ad-miR-494转染组(Ad-miR-494),细胞连续培养5天。第5天空白组和Ad-GFP组细胞的活力分别为刚接种时细胞活力的(622.80±16.1)%和(626.40±11.4)%,见图 2A,两者差异无统计学意义(F=1.05,P=0.693)。而Ad-miR-494组细胞活力为刚接种时的(397.60±17.2)%,显著低于空白组(F=1.101,P=0.014)和Ad-GFP组(F=1.711,P=0.012)。克隆形成实验结果显示,Ad-miR-494组细胞[(34.55±6.84)%]的克隆形成能力较空白组[(69.41±10.47)%]与Ad-GFP组[(69.39±13.41)%]有明显的下降(F=1.351,P=0.011)与(F=2.742,P=0.019),见图 2B。
![]() 图 2 过表达miR-494对骨肉瘤细胞MG-63体外增殖的影响Figure 2 Effects of miR-494 overexpression on proliferation of osteosarcoma cancer cell line MG-63 in vitroA: the effects of miR-494 overexpression on the proliferation of MG-63 cells; B: the effects of miR-494 overexpression on the clone formation ability of MG-63 cells in vitro; *: P<0.05,compared with Ad-GFP group
图 2 过表达miR-494对骨肉瘤细胞MG-63体外增殖的影响Figure 2 Effects of miR-494 overexpression on proliferation of osteosarcoma cancer cell line MG-63 in vitroA: the effects of miR-494 overexpression on the proliferation of MG-63 cells; B: the effects of miR-494 overexpression on the clone formation ability of MG-63 cells in vitro; *: P<0.05,compared with Ad-GFP group2.3 Transwell检测miR-494对MG-63细胞侵袭的影响
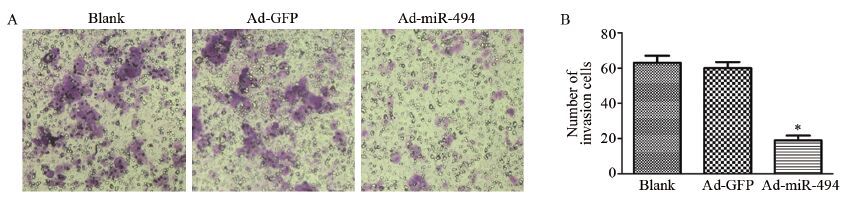
Transwell小室上铺基质胶进行侵袭实验。空白组和Ad-GFP组穿过基质胶的细胞数分别为(63.80±12.5)和(58.20±7.5)个,两者差异无统计学意义(F=2.351,P=0.416),Ad-miR-494组细胞穿过细胞数目为(20.80±5.1)个,较空白组和Ad-GFP组明显减少(F=1.653,P=0.006),见图 3。
2.4 Sox9作为miR-494的靶基因介导MG-63细胞增殖和侵袭
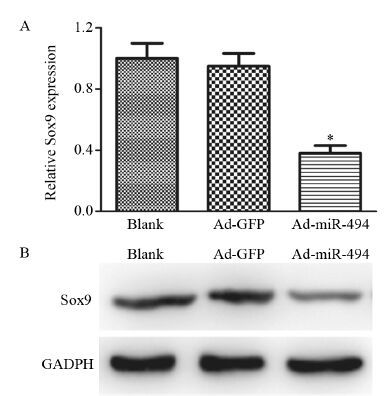
有研究发现Sox9作为miR-494的靶基因参与了软骨肉瘤细胞的增殖和侵袭[9]。在骨肉瘤细胞MG-63中,我们进一步检测在骨肉瘤中Sox9是否也是miR-494的靶基因。空白组、Ad-GFP组和Ad-miR-494组Sox9 mRNA表达水平分别为(1.00±0.11)、(0.91±0.12)、(0.39±0.04),Ad-miR-494组Sox9 mRNA表达明显低于Ad-GFP组(F=5.827,P=0.021),见图 4A。Western blot所得的图像用Quality One做灰度扫描后,用Sox9与GAPDH灰度的比值来代表其相对表达量并进行统计学分析。空白组、Ad-GFP组和Ad-miR-494组Sox9蛋白表达水平分别为(0.96±0.14)、(0.93±0.11)、(0.21±0.01),Ad-miR-494组Sox9蛋白表达明显低于Ad-GFP组(F=5.827,P=0.021),见图 4B 。
2.5 干扰Sox9的表达对MG-63细胞增殖侵袭的影响
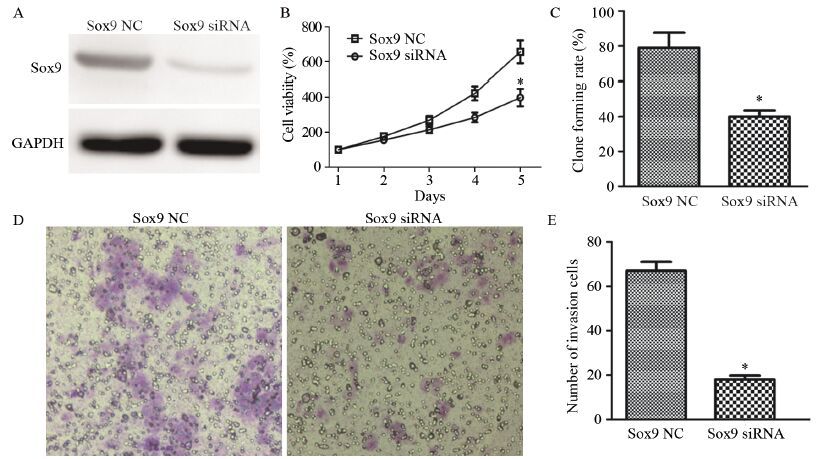
利用siRNA下调Sox9的表达,干扰组Sox9蛋白表达水平(0.12±0.01)较对照组(0.54±0.02)明显下调(t=21.35,P=0.021),见图 5A。Sox9表达下调后,MG-63细胞增殖能力由(639.30±26.1)%下降到(397.60±17.2)%,差异有统计学意义(t=27.54,P=0.042),见图 5B。克隆形成能力由(79.52±21.31)%下降到(40.55±8.37)%,差异有统计学意义(t=29.64,P=0.026),见图 5C。侵袭能力也由(68.50±13.4)下降到(18.50±6.3),差异有统计学意义(t=32.48,P=0.016),见图 5D~5E。
![]() 图 5 Sox9对骨肉瘤细胞MG-63增殖和侵袭的影响Figure 5 Effect of Sox9 on proliferation and invasion abilities of MG-63 cellsA: the expression of Sox9 in osteosarcoma line MG-63 in Sox9 NC group and Sox9 siRNA group detected by Western blot;B: the effects of Sox9 siRNA overexpression on the proliferation of MG-63 cells; C: the effects of Sox9 siRNA overexpression on the clone formation ability of MG-63 cells in vitro; D-E: the effects of Sox9 siRNA overexpression on the invasion of MG-63 cell; *: P<0.05,compared with Sox9 NC group
图 5 Sox9对骨肉瘤细胞MG-63增殖和侵袭的影响Figure 5 Effect of Sox9 on proliferation and invasion abilities of MG-63 cellsA: the expression of Sox9 in osteosarcoma line MG-63 in Sox9 NC group and Sox9 siRNA group detected by Western blot;B: the effects of Sox9 siRNA overexpression on the proliferation of MG-63 cells; C: the effects of Sox9 siRNA overexpression on the clone formation ability of MG-63 cells in vitro; D-E: the effects of Sox9 siRNA overexpression on the invasion of MG-63 cell; *: P<0.05,compared with Sox9 NC group3 讨论
骨肉瘤作为一种恶性肿瘤,越来越多的基因被发现参与到骨肉瘤的发生及发展中,如COX-2、Caspase-3、P53等基因。Sox基因属于HMG超家族,Sox9在多种肿瘤的发展和恶化过程中扮演着重要的角色,在软骨肉瘤组织中Sox9的表达明显高于癌旁非肿瘤组织[9]。Sox9调控TUBB3基因的表达影响卵巢癌的侵袭性[10],在胃癌疾病的发展中,GKN1基因的失活导致Sox9表达异常[11],一系列的研究表明Sox9可能是肿瘤的一个重要靶点,也成为我们研究骨肉瘤发病机制的一个重要方向。有研究发现Sox9与骨肉瘤患者预后密切相关,在骨肉瘤组织中高表达[12]。在本研究中,利用siRNA技术干扰MG-63细胞中Sox9的表达,结果显示Sox9蛋白表达水平明显下调。而Sox9的下调使MG-63细胞的增殖与侵袭能力下降,Zhu的研究也反向证明了本研究的结论[12]。miRNA是目前研究较为成熟的非编码RNA,研究发现有多个miRNA可以靶向调控Sox9基因的表达而进一步参与到疾病的发生、发展及预后:在肺癌中,miR-124靶向调控Sox9抑制肺癌细胞A549增殖、侵袭和转移[13],miR-206在非小细胞肺癌中,通过Sox9基因抑制细胞的侵袭和增殖[14] 。在骨肉瘤中,miR-32通过作用Sox9可以抑制骨肉瘤细胞U2OS增殖和侵袭[15]。本研究发现,Sox9也可以作为miR-494的靶基因,参与骨肉瘤细胞MG-63的增殖和侵袭。首先我们检测过表达miR-494后,骨肉瘤细胞MG-63增殖和侵袭能力的改变情况。体外实验显示miR-494过表达可以抑制MG-63的增殖和侵袭,这和Sox9的下调引起的生物学结果是一致的。为了进一步论证Sox9与miR-494的关系,本研究构建了miR-494腺病毒,发现在MG-63细胞中,转染Ad- miR-494后,miR-494表达明显升高。进一步检测Sox9 mRNA水平与蛋白水平的变化,结果显示,过表达miR-494后,Sox9的mRNA水平和蛋白水平明显下降,这与Li的报道是一致的[9]。由于miRNA是作用在靶基因3‘UTR非编码区,起转录后调控作用,其靶基因mRNA水平往往不发生变化。但是本研究发现,Sox9 mRNA水平也明显下调。虽然已有研究报道Sox9是miR-494的靶基因,但仍需要通过荧光素酶报告基因检测进一步验证miR-494的靶基因。还有一种可能是Sox9是miR-494的靶基因下游的调控基因,因此miR-494过表达后,其mRNA表达水平和蛋白表达水平都表达下降。这将是我们下一步的研究重点,同时寻找Sox9下游的信号通路,为肿瘤的治疗提供更多的治疗靶点。
-
-
[1] Tian J, Li X, Si M, et al. CD271+ osteosarcoma cells display stem-like properties[J]. PLoS One, 2014, 9(6): e98549. doi: 10.1371/journal.pone.0098549
[2] Nugent M. MicroRNA function and dysregulation in bone tumors: the evidence to date[J]. Cancer Manag Res, 2014, 6: 15-25.
[3] Li PF, Chen SC, Xia T, et al. Non-coding RNAs and gastric cancer[J]. World J Gastroenterol, 2014, 20: 5411-9. doi: 10.3748/wjg.v20.i18.5411
[4] Olaru AV, Ghiaur G, Yamanaka S, et al. A microRNA down-regulated in human cholangiocarcinoma control cell cycle through multiple targets involved in the G1/S checkpoint[J]. Hepatology, 2011, 54(6): 2089-98. doi: 10.1002/hep.24591
[5] 麦春平, 陈衍, 姚开泰, 等. miR-494对肺癌细胞株A549及SPCA1生长及侵袭的抑制作用[J]. 广东药学院学报, 2013, 29(2): 185-9. http://www.cnki.com.cn/Article/CJFDTOTAL-GDYX201302019.htm Mai CP, Chen Y, Yao KT, et al. miR-494 suppresses cellproliferation and invasion in lung cancer cells A549 and SPCA1[J]. Guangdong Yao Xue Yuan Xue Bao, 2013, 29(2): 185-9. http://www.cnki.com.cn/Article/CJFDTOTAL-GDYX201302019.htm
[6] 王善伟, 王展怀, 徐侃伦, 等. 结直肠癌相关成纤维细胞的microRNA的差异性表达谱[J]. 现代肿瘤医学, 2013, 21(9): 1918-22. http://www.cnki.com.cn/Article/CJFDTOTAL-SXZL201309004.htm Wang SW, Wang ZH, Xu KL, et al. MiRNA expression analysis of cancer-associated fibroblasts and normal fibroblasts in colorectal cancer[J]. Xian Dai Zhong Liu Yi Xue, 2013, 21(9): 1918-22. http://www.cnki.com.cn/Article/CJFDTOTAL-SXZL201309004.htm
[7] Kwak SY, Yang JS, Kim BY, et al. Ionizing radiation-inducible miR-494 promotes glioma cell invasion through EGFR stabilization by targeting p190B[J]. Biochim Biophys Acta, 2013, 1843(3): 508-16.
[8] Ayyildiz T, Dolar E, Adim SB, et al. Lack of prognostic significance of SOCS-1 expression in colorectal adenocarcinomas [J]. Asian Pac J Cancer Prev, 2014, 15(19): 8469-74. doi: 10.7314/APJCP.2014.15.19.8469
[9] Li J, Wang L, Liu Z, et al. MicroRNA-494 inhibits cell proliferation and invasion of chondrosarcoma cells in vivo and in vitro by directly targeting SOX9[J]. Oncotarget, 2015, 6(28): 26216-29. doi: 10.18632/oncotarget
[10] Raspaglio G, Petrillo M, Martinelli E, et al. Sox9 and Hif-2α regulate TUBB3 gene expression and affect ovarian cancer aggressiveness[J]. Gene, 2014, 542(2): 173-81. doi: 10.1016/j.gene.2014.03.037
[11] Choi YJ, Song JH, Yoon JH, et al. Aberrant expression of SOX9 is associated with gastrokine 1 inactivation in gastric cancers[J]. Gastric Cancer, 2014, 17(2): 247-54. doi: 10.1007/s10120-013-0277-3
[12] Zhu H, Tang J, Tang M, et al. Upregulation of SOX9 in osteosarcoma and its association with tumor progression and patients’prognosis[J]. Diagn Pathol, 2013, 8: 183.
[13] Wang X, Liu Y, Liu X, et al. miR-124 inhibits cell proliferation, migration and invasion by directly targeting SOX9 in lung adenocarcinoma[J]. Oncol Rep, 2016, 35(5): 3115-21.
[14] Zhang YJ, Xu F, Zhang YJ, et al. miR-206 inhibits non small cell lung cancer cell proliferation and invasion by targeting SOX9[J]. Int J Clin Exp Med, 2015, 8(6): 9107-13.
[15] Xu JQ, Zhang WB, Wan R, et al. MicroRNA-32 inhibits osteosarcoma cell proliferation and invasion by targeting Sox9[J]. Tumour Biol, 2014, 35(10): 9847-53. doi: 10.1007/s13277-014-2229-x



 下载:
下载: